
【题目】(1)相同质量的氢气、甲烷(CH4)、水,其中含分子数最多的是________;等物质的量的三种物质含氢原子最多的是________。
(2)某气体氧化物的化学式为RO2,在标准状况下,0.92 g该氧化物的体积为448 mL,则该氧化物的物质的量为______,该氧化物的摩尔质量为______。
(3)某化学兴趣小组对某品牌矿泉水进行检测时,发现1.0 L该矿泉水中含有45.6 mg Mg2+,Mg2+的物质的量浓度为______。
(4)现有0.1 mol·L-1 Na2SO4和0.3 mol·L-1 H2SO4的混合溶液100 mL,向其中逐滴加入0.2 mol·L-1的Ba(OH)2溶液,并不断搅拌,使反应充分进行。(忽略混合过程中的体积变化)
①当加入50 mL Ba(OH)2溶液时,所得溶液中SO42-离子的物质的量浓度为________mol·L-1。
②当溶液中沉淀量达到最大时,所加Ba(OH)2溶液的体积为________mL。
【答案】氢气 氢气 0.02mol 46g/mol 0.0019mol/L 0.2 200
【解析】
(1)根据n=![]() 计算物质的量,再根据n=
计算物质的量,再根据n=![]() 计算分子数目多少;最后结合分子构成判断H原子个数;
计算分子数目多少;最后结合分子构成判断H原子个数;
(2)根据n=![]() 计算气体的物质的量,再根据n=
计算气体的物质的量,再根据n=![]() 计算其摩尔质量;
计算其摩尔质量;
(3)根据n=![]() 、c=
、c=![]() 计算离子的浓度;
计算离子的浓度;
(4)①先计算溶液中SO42-的物质的量,根据SO42-+Ba2+=BaSO4↓,计算加入50 mL Ba(OH)2溶液时消耗的SO42-的物质的量,利用剩余SO42-的物质的量结合c=![]() 计算剩余SO42-的浓度;②当溶液中沉淀量达到最大时,恰好SO42-+Ba2+=BaSO4↓发生完全,n(Ba2+)=n(SO42-),再结合Ba(OH)2溶液的浓度,利用c=
计算剩余SO42-的浓度;②当溶液中沉淀量达到最大时,恰好SO42-+Ba2+=BaSO4↓发生完全,n(Ba2+)=n(SO42-),再结合Ba(OH)2溶液的浓度,利用c=![]() 计算氢氧化钡溶液的体积。
计算氢氧化钡溶液的体积。
(1)设物质的质量都为mg,则H2的物质的量n(H2)=![]() mol,甲烷的物质的量n(CH4)=
mol,甲烷的物质的量n(CH4)=![]() mol,水的物质的量n(H2O)=
mol,水的物质的量n(H2O)=![]() mol,可见,三种物质H2的物质的量最多,根据n=
mol,可见,三种物质H2的物质的量最多,根据n=![]() 可知,物质的量越多,物质内含有的分子数目就越多,故含分子数最多的是氢气;
可知,物质的量越多,物质内含有的分子数目就越多,故含分子数最多的是氢气;
三种物质具有相同质量时,含氢原子的物质的量分别为H2:2×![]() mol=mmol;CH4:4×
mol=mmol;CH4:4×![]() mol=
mol=![]() mol;H2O:2×
mol;H2O:2×![]() mol=
mol=![]() mol,所以含氢原子最多的是氢气;
mol,所以含氢原子最多的是氢气;
(2)n=![]() =0.02mol,根据n=
=0.02mol,根据n=![]() 可知该氧化物的摩尔质量M=
可知该氧化物的摩尔质量M=![]() =46g/mol;
=46g/mol;
(3)n(Mg2+)=![]() =0.0019mol,则根据物质的量浓度定义式可得c=
=0.0019mol,则根据物质的量浓度定义式可得c=![]() =0.0019mol/L;
=0.0019mol/L;
(4)①0.1 mol/L Na2SO4和0.3 mol/L H2SO4的混合溶液100 mL中含有的SO42-的物质的量n(SO42-)=0.1mol/L×0.1L+0.3mol/L×0.1L=0.04mol,当加入50 mL Ba(OH)2溶液时,加入的Ba2+的物质的量n(Ba2+)=0.2mol/L×0.05L=0.01mol,根据SO42-+Ba2+=BaSO4↓可知0.01molBa2+会消耗0.01mol SO42-,剩余反应后溶液中SO42-的物质的量为0.04mol-0.01mol=0.03mol,因此此时溶液中SO42-的浓度c(SO42-)=0.03mol÷0.15L=0.2mol/L;
(2)当溶液中沉淀量达到最大时,SO42-反应完全,根据SO42-+Ba2+=BaSO4↓可知所加Ba(OH)2溶液的物质的量为0.04mol,根据c=![]() 可知此时溶液的体积V[Ba(OH)2]=
可知此时溶液的体积V[Ba(OH)2]= ![]() =0.2L=200mL。
=0.2L=200mL。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】高锰酸钾是一种典型的强氧化剂。
完成下列填空:
Ⅰ.在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
①MnO+Cu2S+H+―→Cu2++SO2↑+Mn2++H2O(未配平)
②MnO+CuS+H+―→Cu2++SO2↑+Mn2++H2O(未配平)
(1)下列关于反应①的说法中错误的是______(填字母序号)。
a.被氧化的元素是Cu和S
b.氧化剂与还原剂的物质的量之比为85
c.生成2.24 L(标况下)SO2,转移电子的物质的量是0.8 mol
d.还原性的强弱关系是:Mn2+>Cu2S
Ⅱ.在稀硫酸中,MnO和H2O2也能发生氧化还原反应
氧化反应:H2O2-2e-===2H++O2↑
还原反应:MnO+5e-+8H+===Mn2++4H2O
(2)反应中若有0.5 mol H2O2参加此反应,转移电子的个数为________。
(3)已知:2KMnO4+7H2O2+3H2SO4===K2SO4+2MnSO4+6O2↑+10H2O,则被1 mol KMnO4氧化的H2O2是______mol。
Ⅲ.高锰酸钾溶液与硫化亚铁有如下反应:10FeS+6KMnO4+24H2SO4===3K2SO4+6MnSO4+5Fe2(SO4)3+10S+24H2O
(4)若上述反应前后固体的质量减少了2.8 g,则硫元素与KMnO4之间发生电子转移的数目为________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢。
(1)A的结构简式为______________________。
(2)A中的碳原子是否都处于同一平面?________(填“是”或“不是”)。
(3)A能发生如下转化,其中D1、D2互为同分异构体,E1、E2互为同分异构体。

反应②的化学方程式为_______________,C的化学名称是__________;E2的结构简式是______________,④、⑥的反应类型依次是______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
化合物G是治疗高血压的药物“比索洛尔”的中间体,一种合成G的路线如下:

已知以下信息:
①A的核磁共振氢谱为单峰;B的核磁共振氢谱为三组峰,峰面积比为6∶1∶1。
②D的苯环上仅有两种不同化学环境的氢;1molD可与1mol NaOH或2mol Na反应。
回答下列问题:
(1)A的结构简式为____________。
(2)B的化学名称为____________。
(3)C与D反应生成E的化学方程式为____________。
(4)由E生成F的反应类型为____________。
(5)G是分子式为____________。
(6)L是D的同分异构体,可与FeCl3溶液发生显色反应,1mol的L可与2mol的Na2CO3反应,L共有______种;其中核磁共振氢谱为四组峰,峰面积比为3∶2∶2∶1的结构简式为___________、____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,Ka1(H2S)=1.3×10-7,Ka2(H2S)=7.1×10-15。不考虑溶液混合引起的体积变化和H2S的挥发,室温时下列指定溶液中微粒物质的量浓度关系正确的是( )
A.0.1mol·L-1NaHS溶液:c(Na+)>c(HS-)>c(H2S)>c(S2-)
B.0.1mol·L-1Na2S溶液:c(OH-)=c(H+)+c(HS-)+c(H2S)
C.0.2mol·L-1NaHS溶液和0.1mol·L-1NaOH溶液等体积混合:c(HS-)+3c(H2S)>c(S2-)
D.向0.1mol·L-1NaOH溶液中通入H2S至溶液呈中性:c(Na+)=c(HS-)+c(S2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述正确的是( )
A.图甲表示相同温度下,在不同容积的容器中进行反应2BaO2(s)![]() 2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
B.图乙表示2NO2(g)![]() N2O4(g)中反应物与生成物的浓度随时间的变化,且在t1时刻达到平衡
N2O4(g)中反应物与生成物的浓度随时间的变化,且在t1时刻达到平衡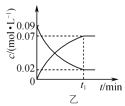
C.图丙表示向0.1mol·L-1NH4Cl溶液中滴加0.1mol·L-1盐酸时,溶液中![]() 随盐酸体积的变化关系
随盐酸体积的变化关系
D.图丁表示向pH、体积均相同的HCl、CH3COOH溶液中分别加入过量锌粉,产生的H2体积随时间的变化,其中曲线a表示HCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作不能达到实验目的的是( )

A.用装置甲制备NH3
B.用装置乙除去SO2气体中的少量HCl
C.用湿润的红色石蕊试纸检验NH3
D.中和滴定时,滴定管用待装的试液润洗2~3次,减小实验误差
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )
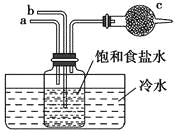
A. a通入CO2,然后b通入NH3,c中放碱石灰
B. b通入NH3,然后a通入CO2,c中放碱石灰
C. a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
D. b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化钒(VO2)是一种新型热敏材料。+4价的钒化合物在弱酸性条件下易被氧化。实验室以V2O5为原料合成用于制备VO2的氧钒(Ⅳ)碱式碳酸铵晶体,过程如下:

回答下列问题:
(1) VOC12中V的化合价为 ________。
(2)步骤i中生成VOC12的同时生成一种无色无污染的气体,该化学方程式为___。也可只用浓盐酸与V2O5来制备VOC12溶液,该法的缺点是 _______
(3)步骤ii可在下图装置中进行。

①反应前应通入CO2数分钟的目的是 ________。
②装置B中的试剂是____。
(4)测定氧钒(IV)碱式碳酸铵晶体粗产品中钒的含量。
称量ag样品于锥形瓶中,用20mL蒸馏水与30 mL混酸溶解后,加0.02 mol/LKMnO4溶液至稍过量,充分反应后继续加1 %NaNO2溶液至稍过量,再用尿素除去过量的NaNO2,最后用c mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗体积为b mL。滴定反应为:VO2++Fe2++2H+= VO2++Fe3++H2O.
①KMnO4溶液的作用是_______ 。NaNO2溶液的作用是______ 。
②粗产品中钒的质量分数的表达式为_________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com