
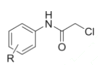
����Ŀ��Ϊ��Ѱ�Ҹ�Ч�Ͷ��Ŀ�����ҩ���ѧ���Ǻϳ���һϵ�����͵�1��3- ��ȡ��̪�ͪ�������
(1)������B �еĺ���������Ϊ__________��__________(�����������)��
(2)��Ӧi-iv������ȡ����Ӧ����___________��
(3)ii�ķ�Ӧ����ʽΪ___________��
(4)ͬʱ��������������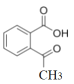 ��ͬ���칹�干��_____�֣�д������һ�ֵĽṹ��ʽ�� _______
��ͬ���칹�干��_____�֣�д������һ�ֵĽṹ��ʽ�� _______
I.�����к�������II.�ɷ���������Ӧ��III.�˴Ź������������Ϊ1��2��2��2��1
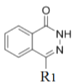
(5)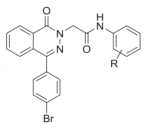 ��һ�ָ�Ч�Ͷ��Ŀ�����ҩ���д����
��һ�ָ�Ч�Ͷ��Ŀ�����ҩ���д����![]() ��
�� ��
�� Ϊԭ���Ʊ��û�����ĺϳ�·������ͼ(���Լ�����)��______________��
Ϊԭ���Ʊ��û�����ĺϳ�·������ͼ(���Լ�����)��______________��
���𰸡��Ȼ� �ʻ� ���������� 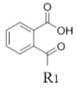 +N2H4
+N2H4![]()
 +2H2O 6
+2H2O 6  ��
�� ��
��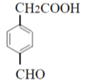 ��
��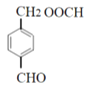 ��
��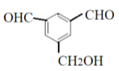 ��
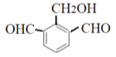
��

��������
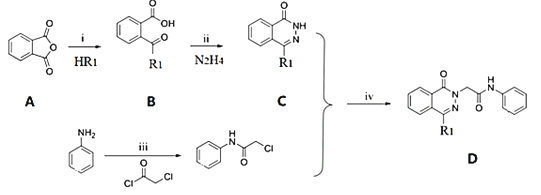
(1)����B�ṹ��ʽȷ���京�еĹ����ţ�
(2)����i-iv�з�Ӧ���ص�����ж�i-iv�е�ȡ����Ӧ��
(3) ��N2H4����ȡ����Ӧ����
��N2H4����ȡ����Ӧ���� ��H2O���ݴ���д��Ӧ����ʽ��
��H2O���ݴ���д��Ӧ����ʽ��
(4)  ��ͬ���칹������������I.�����к�������II.�ɷ���������Ӧ��˵�������к���ȩ����Ҳ���ܺ��м����γɵ�������III.�˴Ź������������Ϊ1��2��2��2��1���ݴ���д���ܵ�ͬ���칹��ṹ��ʽ���ж���������Ŀ��
��ͬ���칹������������I.�����к�������II.�ɷ���������Ӧ��˵�������к���ȩ����Ҳ���ܺ��м����γɵ�������III.�˴Ź������������Ϊ1��2��2��2��1���ݴ���д���ܵ�ͬ���칹��ṹ��ʽ���ж���������Ŀ��
(5)�������еĺϳɵ����̣��Ա�Ҫ�ϳɵ�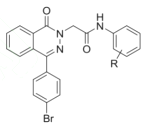 ��
��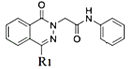 �IJ�ͬ�����Կ���ֻҪ����
�IJ�ͬ�����Կ���ֻҪ���� �ĺϳ�·�ߣ���ϸ�����ԭ�ϣ�������Ƴ��ϳ�·�ߡ�
�ĺϳ�·�ߣ���ϸ�����ԭ�ϣ�������Ƴ��ϳ�·�ߡ�
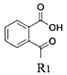
(1)B�ṹ��ʽΪ ����֪������B�к��еĹ�����Ϊ�Ȼ����ʻ���
����֪������B�к��еĹ�����Ϊ�Ȼ����ʻ���
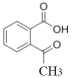
(2)ȡ����Ӧ���л�������е�ijЩԭ�ӻ�ԭ���ű�����ԭ�ӻ�ԭ����������ķ�Ӧ���������ʵĽṹ��ʽ���仯����֪��Ӧii�� ��C=Oԭ����Oԭ�ӱ�N2H4������Nԭ�Ӵ��棬-OH��NHԭ�Ӵ��棬�õ�
��C=Oԭ����Oԭ�ӱ�N2H4������Nԭ�Ӵ��棬-OH��NHԭ�Ӵ��棬�õ�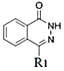 ��H2O���÷�ӦΪȡ����Ӧ����Ӧiii��
��H2O���÷�ӦΪȡ����Ӧ����Ӧiii��![]() ��-NH2�ϵ�Hԭ�ӱ�
��-NH2�ϵ�Hԭ�ӱ�![]() ����õ�
����õ�![]() ��HCl���÷�ӦΪȡ����Ӧ����Ӧiv��
��HCl���÷�ӦΪȡ����Ӧ����Ӧiv��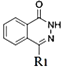 �϶���N-H����Hԭ�ӱ�
�϶���N-H����Hԭ�ӱ�![]() ȡ���õ�
ȡ���õ�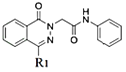 ��ͬʱ����HCl���÷�ӦΪȡ����Ӧ���ʷ�Ӧ��i-iv������ȡ����Ӧ���Ǣ�����������
��ͬʱ����HCl���÷�ӦΪȡ����Ӧ���ʷ�Ӧ��i-iv������ȡ����Ӧ���Ǣ�����������
(3)��Ӧii�� ��N2H4��һ�������·�Ӧ����
��N2H4��һ�������·�Ӧ����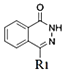 ��H2O���÷�Ӧ�Ļ�ѧ����ʽΪ
��H2O���÷�Ӧ�Ļ�ѧ����ʽΪ +N2H4
+N2H4![]()
 +2H2O��
+2H2O��
(4) 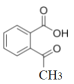 ��ͬ���칹������������I.�����к�������II.�ɷ���������Ӧ��˵�������к���ȩ����III.�˴Ź������������Ϊ1��2��2��2��1��˵�������к���5�ֲ�ͬ��Hԭ�ӣ�������Ϊ1��2��2��2��1������ܵĽṹΪ
��ͬ���칹������������I.�����к�������II.�ɷ���������Ӧ��˵�������к���ȩ����III.�˴Ź������������Ϊ1��2��2��2��1��˵�������к���5�ֲ�ͬ��Hԭ�ӣ�������Ϊ1��2��2��2��1������ܵĽṹΪ ��
�� ��
�� ��
�� ��
�� ��
�� ����6�֣�
����6�֣�
(5)�����Ϸ�����֪�����ȱ���Br2��Fe���·���ȡ����Ӧ�����屽��![]() ��
��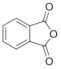 �����λ�Ϸ�����Ӧ����
�����λ�Ϸ�����Ӧ���� ��
�� ��N2H4����ȡ����Ӧ����
��N2H4����ȡ����Ӧ����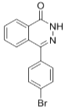 ��
��  ��
��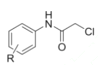 ����ȡ����Ӧ����
����ȡ����Ӧ���� ��HCl������
��HCl������![]() ��
�� ��
�� Ϊԭ���Ʊ��û�����ĺϳ�·������ͼΪ��
Ϊԭ���Ʊ��û�����ĺϳ�·������ͼΪ�� ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ش��������⣺
��1��Ǧ���ص��ܷ�ӦΪ��Pb + PbO2 + 2H2SO4 ![]() 2PbSO4 + 2H2O���ŵ�ʱ��������ӦʽΪ___________�����ʱ��������ӦʽΪ___________��
2PbSO4 + 2H2O���ŵ�ʱ��������ӦʽΪ___________�����ʱ��������ӦʽΪ___________��
��2��������ͼװ�ã�����ģ�����ĵ绯ѧ������
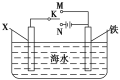
����XΪʯī��Ϊ�������ĸ�ʴ��������K���ڣδ����õ绯ѧ��������Ϊ___________��
����XΪп������K����M�����õ绯ѧ��������Ϊ__________��
��3���ҹ��ĿƼ���ԱΪ������SO2����Ⱦ������ԭ���ԭ���������ͼ2װ����SO2��O2�Ʊ����ᣬ�缫A��BΪ��IJ��ϡ�
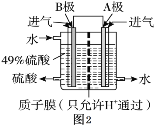
�� A���ĵ缫��Ӧʽ��________��
�� B���ĵ缫��Ӧʽ��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼�������ڿ��������յõ�����������A��һ�����塣ijѧϰС��Ϊ��̽����������A��������������ʵ�鷽����
������
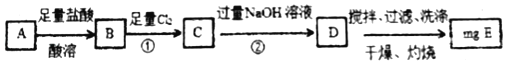
(1)���÷����Т�ͨ��Cl2��������С���Ա��Ϊ����ͨ���ڿ����г�ֽ���D������ʵ��ȷ�ⶨ������������_____(�û�ѧ����ʽ��ʾ)
(2)��������A��������7.8400g��E������Ϊ8.0000g�������ݼ��㻯����A�Ļ�ѧʽΪ_____��
������
�ٳ�ȡag������A��Ʒ��������ϡ���ᣬ�����100mL��Һ��
��ȡ20.00 mL����Һ����ƿ�У��μӼ���KSCN��Һ����Һ���ɫ���ٵμ�˫��ˮ����ɫ�պ���ȥ��ͬʱ������������(������ʾSCN-�ɱ�H2O2����������ΪN2��CO2��SO42��)
�۴�������ʧ���� b mol/LKI����Һ�ζ���ƿ�е�Fe3+���ζ��յ�ʱ����cmL KI����Һ��
(3)�÷����õ��Ķ�����������Ͳ��������ƽ����ʽ�ζ��ܡ�_____��
(4)������еμ�KSCN��Һ��Ŀ����_____��
(5)����������ʵ�鲽����õ�����ʽ�ζ��ܵ���ϴ�������رյζ������������Ͽ�ע��3��5mL��װҺ��_____���ظ�2��3�Ρ�
(6)������ܷ�ѡ�õ�����ָʾ��_____��(����������������)
(7)�е�ͬѧͨ������������϶Ը�С���ʵ����ƽ��������ۣ�����˵����������_____
A.������ʾ��HSCN�о綾���ӷ�����˸÷�������ڿ��������HSCN��������ʵ�鰲ȫ�Ե�Ҫ��
B.�����������H2O2�������������費���Դ���Ҳ�����ʵ��������κ�Ӱ�졣
C.������ʾ��Fe3+��I��֮��ķ�Ӧ�����ԵĿ��淴Ӧ����������۾ͻ���ɵζ��ⶨ��ȷ
(8)�е�ͬѧ��̼�������Ļ�ò�������Ȥ��ͨ���������Ϸ���̼��������ͨ��̼�����ƺ�������������Fe2++2HCO3��FeCO3��+H2CO3�Ƶã������÷�Ӧ��ƽ�ⳣ��K��_____(mol/L)��2�����õ��Ľɾ����£�Ksp(FeCO3)��3.20��10��11��H2CO3��Ka1��4.30��10��7��Ka2��5.61��10��11��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������pH������̽��NaOH��Һ�����ᡢ����ͭ�����Һ������Ӧ�����ӷ�Ӧ˳�����������ͼ��ͼ����֪ʵ��ʹ�õ�NaOH��ҺŨ�Ⱥ͵�����ͬ��������Һ������ͭ��ҺŨ����ͬ�������Һ�������ʵ�Ũ��Ҳ��ͬ��
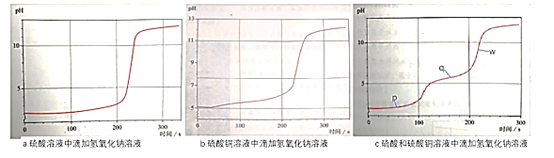
���½���������
A.����ʱ���c(Cu2+)��p>q>w
B.w�㣺c(Na+)>c(SO42-)>c(Cu2+)>c(H+)
C.�����Һ�еμ�NaOH��Һ��������������ͭ������Ӧ
D.q��ʱ��Һ����Ũ�ȣ�c(SO42-)+c(OH-)=c(Cu2+)+c(H+)+c(Na+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ѳ���ҵ�����еĵ�������(��Ҫ��ָNO��NO2)���Ծ������������ƻ������ǻ�����������Ҫ���⡣
(1)����������NH3��ԭ�����ɽ�NOx��ԭΪN2�����ѳ���
��֪����4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ��H=-905.9 kJ/mol
4NO(g)+6H2O(g) ��H=-905.9 kJ/mol
��N2(g)+O2(g)![]() 2NO(g) ��H=+180 kJ/mol
2NO(g) ��H=+180 kJ/mol
��H2O(g)![]() H2O(l) ��H=-44 kJ/mol
H2O(l) ��H=-44 kJ/mol
д�������£�NH3��ԭNO��Ӧ���Ȼ�ѧ����ʽ��____________��
(2)��Ư�۾���ҺΪ���ռ�������Ч�ѳ������е�NO��
��Ư�۾���Һ����Ҫ�ɷ���Ca(ClO)2�������չ����У����ĵ�Ca(ClO)2�����յ�NO�����ʵ���֮��Ϊ3��4�����ѳ���NOת��Ϊ____________��
��ijһ��ȤС���о���ͬ�¶�����ͬŨ��Ư�۾���Һ��NO�ѳ��ʵ�Ӱ�죬�����ͼ��ʾ��

ͼ�У�40��60�� NO�ѳ����������ܵ�ԭ��Ϊ____________��60��80�� NO�ѳ����½����ܵ�ԭ��Ϊ____________��
(3)��������(Na2S2O8)����ȥ��NO
��һ����NO�ڼ��Ի����б�Na2S2O8����ΪNaNO2
�ڶ����� NaNO2����������ΪNaNO3����ӦΪNO2-+S2O82-+2OH-![]() NO3-+2SO42-+H2O����ͬ�¶��£�ƽ��ʱNO2-���ѳ������������(Na2S2O8)��ʼŨ��(ָ�ڶ�����Ӧ�ij�ʼŨ��)�Ĺ�ϵ��ͼ��ʾ��
NO3-+2SO42-+H2O����ͬ�¶��£�ƽ��ʱNO2-���ѳ������������(Na2S2O8)��ʼŨ��(ָ�ڶ�����Ӧ�ij�ʼŨ��)�Ĺ�ϵ��ͼ��ʾ��
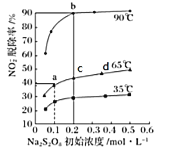
��a��b��c��d�ĵ�ƽ�ⳣ��K�ɴ�С��˳��Ϊ____________��ԭ����____________��
����a��(0.1��40%)ʱ��NO2-�ij�ʼŨ��Ϊa mol��L-1��ƽ��ʱpH=13����65��ʱ���ڶ�����Ӧ��ƽ�ⳣ��K=____________��(�ú�a�Ĵ���ʽ��ʾ)
(4)�������Ͳ��Ϲ���ѳ�NO����ͼ��ʾ��

ij�绯С�齫����A��B��Ƴ����Ե��ط�Ӧ����÷�Ӧ��������ӦΪ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���1L0.3mol L1HA��Һ��0.1molNaOH�����ϣ�ʹ֮��ַ�Ӧ�õ���Һ(a)��Ȼ�������Һ��ͨ��HCl�����NaOH���壨����������¶ȱ仯������ҺpH��ͨ���ӣ������ʵ����ı仯��ͼ�����������������

A. HA��һ������
B. ��a���Ӧ��Һ��ͨ��HCl����ַ�Ӧ��c(H+)/c(HA)����
C. b���Ӧ��Һ�У�c(Na+)=c(Cl-)>c(HA)>c(H+)>c(OH-)
D. c���Ӧ��Һ�У�c(Na+)=c(A-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ܡ����Ƚ������仯�����ڿ�ѧ�о���ҵ������Ӧ��ʮ�ֹ㷺���ش��������⣺
��1�������ܡ����Ļ�̬ԭ�Ӻ���δ�ɶԵ�����������_________��
��2��̪ݼ�ܷ��ӵĽṹ��ʽ��ͼ��ʾ����������Ϊ�����ӣ�̪�ܷ�������������ͨ����λ����ϵĵ�ԭ�ӵı����_______(��1��2��3��4)�����ַǽ���ԭ�ӵĵ縺���ɴ�С��˳��Ϊ_______(����Ӧ��Ԫ�ط��ű�ʾ)����ԭ�ӵ��ӻ��������Ϊ________��

��3��Fe(CO)x�����³�Һ̬���۵�Ϊ-20.5�棬�е�Ϊ103�棬�����ڷǼ����ܼ����ݴ˿��ж�Fe(CO)x����������_______(�������)���������Fe(CO)x������ԭ�Ӽ۵������������ṩ������֮��Ϊ18����x=________��
��4��NiO��FeO�ľ���ṹ�������Ȼ��Ƶ���ͬ��Ni2+��Fe2+�����Ӱ뾶�ֱ�Ϊ69pm��78pm�����۵�NiO______FeO(����>����<������=��)��ԭ����_________��
��5��NiAs�ľ����ṹ��ͼ��ʾ���������ӵ���λ��Ϊ_________��
���������ӵ�������ֵΪNA�������ܶ�Ϊpg��cm-3����þ����������Ni2+֮��ľ���Ϊ________cm��(д���������ʽ)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����н�������A��B��C������ס��ҡ����Լ�����D��E��F��G��H������֮����ת����ϵ����ͼ��ʾ��ͼ����Щ��Ӧ��������ͷ�Ӧ������û�б������
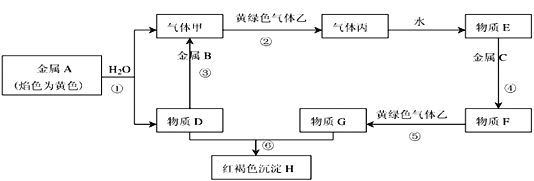
��ش��������⣺
��1��д���������ʵĻ�ѧʽ����_________����_________��
��2��ͼ�з�Ӧ�٢ڢۢܢݢ�������������ԭ��Ӧ���У�_____________________ �������û���Ӧ��Ӧ���У�_______________ ��
��3��д����Ӧ�ݵ����ӷ���ʽ��_____________________��
��4��д����Ӧ�ٵĻ�ѧ����ʽ_______________________________ �����õ���״�� �µļ�����2.24L����μӷ�Ӧ�Ľ���A____________ g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���X(C4H6O5)�㷺����������ˮ���ڣ��������ѡ����ϡ�ɽ����Ϊ�࣬X��̼���ṹ��֧��������ʽΪC4H6O5��1.34gX������������Һ��Ӧ�����ɱ�״���µ�����0.336L��X�봼��������ŨH2SO4�ͼ��ȵ������¾���������ζ�IJ��X��һ�������¿ɷ�������ת����X![]() A
A![]() B
B![]() C(X��A��B��C������̼ԭ����Ŀ��ͬ)�������й�˵���в���ȷ����( )
C(X��A��B��C������̼ԭ����Ŀ��ͬ)�������й�˵���в���ȷ����( )
A. X�Ľṹ��ʽΪHOOC��CHOH��CH2��COOH
B. A�ķ���ʽΪC4H4O4
C. ��M�Ĺ��������ࡢ������ȫ��ͬ��ͬ���칹�廹��3��
D. C����������ˮ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com