
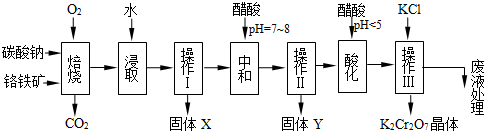
重铬酸钾(K2Cr2O7)是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO·Cr2O3)为原料生产。实验室模拟工业生产如下图:
|
 涉及的主要反应为:
涉及的主要反应为:
6FeO·Cr2O3+24NaOH+7KClO3 12Na2CrO4 +3Fe2O3+7KCl+12H2O

 在反应器中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐。氧化铝与碳酸钠发生的反应为Al2O3 + Na2CO3
2NaAlO2 +CO2↑,生成的偏铝酸钠(NaAlO2)可与水反应NaAlO2+2H2O
NaAl(OH)4
在反应器中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐。氧化铝与碳酸钠发生的反应为Al2O3 + Na2CO3
2NaAlO2 +CO2↑,生成的偏铝酸钠(NaAlO2)可与水反应NaAlO2+2H2O
NaAl(OH)4
 Al(OH)3+NaOH。
Al(OH)3+NaOH。
(1)写出二氧化硅与碳酸钠反应的化学方程式 。
(2)NaFeO2能强烈水解,在操作②中生成沉淀而除去,试写出该反应的化学方程式:
。
(3)操作③调节后溶液的pH比原来降低,调节的目的是(用简要的文字和必要的离子方程式说明)
。
(4)称取重铬酸钾(K2Cr2O7式量为294)试样m g配成VmL溶液,取出V1 mL于锥形瓶中,加入适量的稀H2SO4和足量碘化钾,放于暗处5min,然后加入100mL水,同时加入3mL淀粉溶液作指示剂,用c mol•L-1Na2S2O3标准溶液滴定(相关反应为: Cr2O72-+6I-+14H+= 2Cr3++3I2+7H2O、I2+2S2O32-=2I-+S4O62- )。则:
①取V1 mL待测液应选用的仪器为 (写仪器名称)。
②判断达到滴定终点的依据是 。
③设整个过程中其它杂质不参与反应。若实验中共用去Na2S2O3标准溶液V2mL,则计算所得产品中重铬酸钾纯度的代数式为
(不必化简)。
(1)SiO2 +Na2CO3 Na2SiO3 + CO2↑(2 分)
(2)NaFeO2 + 2H2O = Fe(OH)3↓ + NaOH(2分)


 (3)由于硅酸钠和偏铝酸钠在溶液中发生水解,SiO32-+H2O
HSiO3-+OH-、HSiO3-+H2O
H2SiO3+OH-、AlO2-+2H2O Al(OH)3+OH-,降低pH有利于水解平衡向正反应方向移动(1分),当pH调到7~8时能使它们完全水解生成沉淀(1分)
(3)由于硅酸钠和偏铝酸钠在溶液中发生水解,SiO32-+H2O
HSiO3-+OH-、HSiO3-+H2O
H2SiO3+OH-、AlO2-+2H2O Al(OH)3+OH-,降低pH有利于水解平衡向正反应方向移动(1分),当pH调到7~8时能使它们完全水解生成沉淀(1分)
(4)①酸式滴定管(或移液管,1分,答成滴定管、量筒不给分)
②当滴加最后一滴硫代硫酸钠溶液,溶液蓝色褪去且半分钟内不复现(1分)
③ 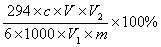 (2分)
(2分)


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 750℃ |
| 750℃ |
| 物质 | 溶解度/(g/100g水) | ||
| 0°C | 40°C | 80°C | |
| KCl | 28 | 40.1 | 51.3 |
| NaCl | 35.7 | 36.4 | 38 |
| K2Cr2O7 | 4.7 | 26.3 | 73 |
| Na2Cr2O7 | 163 | 215 | 376 |
| 26m |
| 17n |
| 26m |
| 17n |
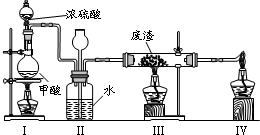
查看答案和解析>>
科目:高中化学 来源: 题型:
(2012?西城区二模)下列实验结论不正确的是( )
|
查看答案和解析>>
科目:高中化学 来源: 题型:
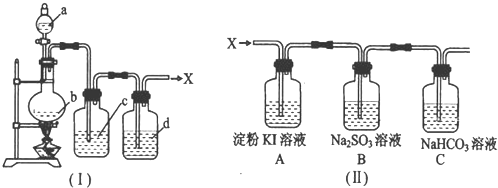
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验操作 | 现象 | 结论 | |
| A | 淀粉溶液中加入碘水 | 溶液变蓝 | 说明淀粉没有水解 |
| B | 将乙醇与酸性重铬酸钾(K2Cr2O7)溶液混合 | 橙色溶液变为绿色 | 乙醇具有还原性 |
| C | 蔗糖溶液中加入稀硫酸,水解后加入银氨溶液,水浴加热 | 未出现银镜 | 水解的产物为非还原性糖 |
| D | 将新制Cu(OH)2与葡萄糖溶液混合加热 | 产生红色沉淀(Cu2O) | 葡萄糖具有氧化性 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com