
【题目】下列关于元素周期表和元素周期律的说法中正确的是
A. 目前已发现的所有元素占据了周期表里全部位置,不可能再有新的元素被发现
B. 元素的性质随着原子序数的增加而呈周期性变化
C. 元素周期表中共有18列,对应18个族
D. 元素周期表中右上方区域的非金属元素多用于制造半导体材料
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】东晋葛供《肘后备急方》中“青蒿一握,以水升渍,绞取汁,尽服之”。下列操作与“渍”和“绞”原理相近的是( )
A. 浸泡 过滤 B. 煮沸 研碎 C. 萃取 剪断 D. 蒸馏 捣碎
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子的性质是由分子的结构决定的,通过对下列分子结构的观察来推测它的性质:
![]()
(1)苯基部分可发生____反应和____反应。
(2)—CH![]() CH2部分可发生____反应和___反应。
CH2部分可发生____反应和___反应。
(3)写出此有机物形成的高分子化合物的结构简式:_______。
(4)试判断此有机物的—C(CH2Cl)3部分_______(填“能”或“不能”)发生消去反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2014新课标2】37.[化学选修——3:物质结构与性质]
周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子。回答下列问题:
(1)b、c、d中第一电离能最大的是 (填元素符号),e的价层电子轨道示意图为 。
(2)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为 ;分子中既含有极性共价键,又含有非极性共价键的化合物是 (填化学式,写两种)。
(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是 ;酸根呈三角锥结构的酸是 。(填化学式)
(4)e和c形成的一种离子化合物的晶体结构如图1,则e离子的电荷为 。
(5)这5种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构;阳离子呈轴向狭长的八面体结构(如图2所示)。该化合物中阴离子为 ,阳离子中存在的化学键类型有 ;该化合物加热时首先失去的组分是 ,判断理由是 。
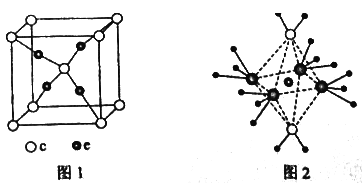
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。

已知①无水氯化钙可与乙醇形成难溶于水的CaCl2·6 C2H50H ②有关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
请回答:
(1)浓硫酸的作用是___________________;若用同位素180示踪法确定反应产物水分子
中氧原子的提供者,写出能表示180位置的化学方程式:_____________________。
(2)球形干燥管C的作用是______________。若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示)______________________;反应结束后D中的现象是_________________。
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出___________;再加入(此空从下列选项中选择)________,然后进行蒸馏,收集77℃左右的馏分,以得较纯净的乙酸乙酯。
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式不正确的是
A. 实验室制乙炔:CaC2+2H2O→Ca(OH)2+C2H2↑
B. 丁二烯的1,4-加成:H2C=CHCH=CH2+Cl2→CH2ClCH=CHCH2Cl
C. 向苯酚钠溶液中加入少量CO2:

D. 乙醛与新制氢氧化铜反应:CH3CHO+2Cu(OH)2+NaOH![]() CH3COONa+Cu2O↓+3H2O
CH3COONa+Cu2O↓+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2015山东卷】毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:

(1)毒重石用盐酸浸取前需充分研磨,目的是 。实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的 。
a.烧杯 b.容量瓶 c.玻璃棒 d.滴定管
(2)
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
加入NH3·H2O调节pH=8可除去 (填离子符号),滤渣Ⅱ中含 (填化学式)。加入H2C2O4时应避免过量,原因是 。
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
(3)利用简洁酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO42—+2H+=Cr2O72—+H20 Ba2++CrO42—=BaCrO4↓
步骤Ⅰ 移取xml一定浓度的Na2CrO4溶液与锥形瓶中,加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL。
步骤Ⅱ:移取y mLBaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ 相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL。
滴加盐酸标准液时应用酸式滴定管,“0”刻度位于滴定管的 (填“上方”或“下方”)。BaCl2溶液的浓度为 mol·L-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将 (填“偏大”或“偏小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用元素周期律解释的是
A. 酸性:HClO4 > H2SO3 B. 碱性:NaOH > Mg(OH)2
C. 气态氢化物的稳定性:H2O > H2S D. Cl2从NaBr溶液中置换出Br2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com