
 2NH3↑+CaCl2+2H2O;②联合制碱法 NH3+CO2+H2O+NaCl(饱和)=NaHCO3↓+NH4Cl; 2NaHCO3
2NH3↑+CaCl2+2H2O;②联合制碱法 NH3+CO2+H2O+NaCl(饱和)=NaHCO3↓+NH4Cl; 2NaHCO3 Na2CO3+CO2↑+H2O.炼钢时,加入硅、锰和铝主要是可以脱氧和调整钢的成分. 因为Cr易被氧化,为防止Cr被氧化,不锈钢含有的Cr元素是在炼钢过程的氧吹后,若氧吹前加入Cr会形成炉渣被除去.炼铁和炼钢生产中,CO是主要的还原剂,故尾气均含有的主要污染物是CO,一氧化碳会引起中毒,故需对其进行处理等来解题.
Na2CO3+CO2↑+H2O.炼钢时,加入硅、锰和铝主要是可以脱氧和调整钢的成分. 因为Cr易被氧化,为防止Cr被氧化,不锈钢含有的Cr元素是在炼钢过程的氧吹后,若氧吹前加入Cr会形成炉渣被除去.炼铁和炼钢生产中,CO是主要的还原剂,故尾气均含有的主要污染物是CO,一氧化碳会引起中毒,故需对其进行处理等来解题. 2NH3↑+CaCl2+2H2O,
2NH3↑+CaCl2+2H2O, 2NH3↑+CaCl2+2H2O;
2NH3↑+CaCl2+2H2O; Na2CO3+CO2↑+H2O,
Na2CO3+CO2↑+H2O, Na2CO3+CO2↑+H2O;
Na2CO3+CO2↑+H2O; 

科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 2NH3↑+CaCl2+2H2O
2NH3↑+CaCl2+2H2O 2NH3↑+CaCl2+2H2O
2NH3↑+CaCl2+2H2O Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O查看答案和解析>>
科目:高中化学 来源: 题型:

| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
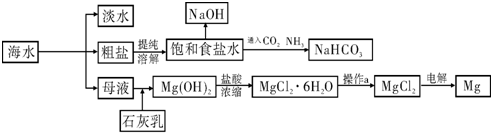
| MgO | MgCl2 | |
| 熔点/℃ | 2852 | 714 |
| 沸点/℃ | 3600 | 1412 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com