
 焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一.某研究小组进行如下实验:
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一.某研究小组进行如下实验:

| 0.016g |
| 0.1L |


科目:高中化学 来源: 题型:
| A、碱性锌锰电池中,MnO2是催化剂 |
| B、银锌纽扣电池工作时,Ag2O被还原为Ag |
| C、放电时,铅酸蓄电池中硫酸浓度不断增大 |
| D、电镀时,待镀的金属制品表面发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol N2与足量的H2反应,转移的电子数是0.6NA |
| B、常温下,0.1mol?L-1 NH4NO3溶液中含有的氮原子数是0.2NA |
| C、常温常压下,3.2g O2和3.2g O3所含氧原子数都是0.2NA |
| D、2.24L CO和CO2的混合气体中所含的碳原子数为0.1N A |
查看答案和解析>>
科目:高中化学 来源: 题型:
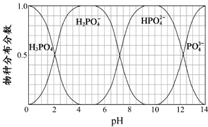 磷和砷是同主族的非金属元素.
磷和砷是同主族的非金属元素.查看答案和解析>>
科目:高中化学 来源: 题型:
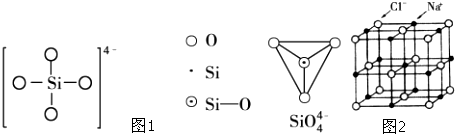
| 电离能/kJ?mol-1 | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
查看答案和解析>>
科目:高中化学 来源: 题型:
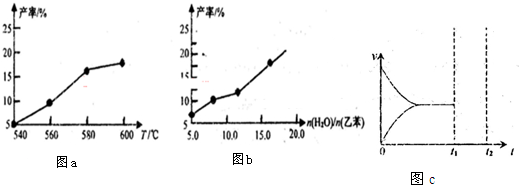
| n(H2O) |
| n(乙苯) |
查看答案和解析>>
科目:高中化学 来源: 题型:
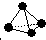 ,已知断裂1mol N-N键吸收167kJ的热量,生成1mol N≡N键放出942kJ热量.试判断相同条件下N4与N2的稳定性顺序是:
,已知断裂1mol N-N键吸收167kJ的热量,生成1mol N≡N键放出942kJ热量.试判断相同条件下N4与N2的稳定性顺序是:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分液时,分液漏斗中上层液体应从漏斗口倒出 |
| B、蒸馏时,温度计水银球靠近蒸馏烧瓶支管口 |
| C、滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中的液面 |
| D、蒸发时,当蒸发到剩有少量液体时,停止加热,利用余热将液体蒸干 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素Z、W的简单离子的电子层结构相同 |
| B、元素Y的简单气态氢化物的热稳定性比Z的弱 |
| C、由X、Y、Z三种元素形成化合物,其水溶液可能显碱性 |
| D、W、Z两种元素形成的化合物中肯定不含共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com