
 过二硫酸的化学式为H2S2O8,硫元素的形式氧化态可看作是+7,所以是一种强氧化剂.工业上常用电解硫酸和硫酸钾的混合溶液制过二硫酸钾,且在65℃时熔化并分解.电解反应的离子方程式是:2HSO
过二硫酸的化学式为H2S2O8,硫元素的形式氧化态可看作是+7,所以是一种强氧化剂.工业上常用电解硫酸和硫酸钾的混合溶液制过二硫酸钾,且在65℃时熔化并分解.电解反应的离子方程式是:2HSO- 4 |
| ||
2- 8 |
- 4 |
| ||
2- 8 |


科目:高中化学 来源: 题型:
| A、0.6 mol/L |
| B、0.8 mol/L |
| C、1.0 mol/L |
| D、1.2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
14 6 |
14 6 |
| A、中子数为14 | ||
| B、质子数为14 | ||
| C、核外电子数为14 | ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 工、农业废水以及生活污水中浓度较高的NO3-会造成氮污染.工业上处理水体中NO3-的一种方法是零价铁化学还原法.某化学小组用废铁屑和硝酸盐溶液模拟此过程,实验如下.
工、农业废水以及生活污水中浓度较高的NO3-会造成氮污染.工业上处理水体中NO3-的一种方法是零价铁化学还原法.某化学小组用废铁屑和硝酸盐溶液模拟此过程,实验如下.查看答案和解析>>
科目:高中化学 来源: 题型:
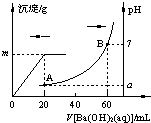 室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol?L-1Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化).下列说法正确的是( )
室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol?L-1Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化).下列说法正确的是( )| A、图中A点对应溶液的pH:a=1 |
| B、生成沉淀的最大质量m=2.33g |
| C、原混合液中c(HCl)=0.2mol?L-1 |
| D、当V[Ba(OH)2(aq)]=30mL时,有关离子浓度大小:c(Cl-)>c(Ba2+)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
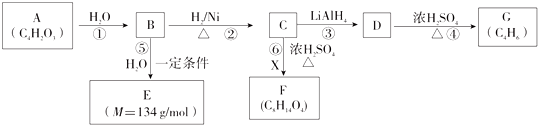
| H2O |
| LiAlH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
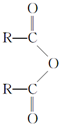
 A
A| 一定条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 某溶液W进行焰色反应实验 | 焰色为黄色 | W一定是钠盐溶液 |
| B | 蘸有浓氨水的玻璃棒靠近溶液X | 有白烟产生 | X可能是浓盐酸 |
| C | 强酸性溶液Y中加入Ba(NO3)2溶液,静置后再加入KSCN溶液 | 先有白色沉淀,后溶液又变红 | Y中一定含有SO42-和Fe3+ |
| D | 气态炔烃Z通入pH=α的溴水中 | 溴水褪色,溶液的pH>α | Z与溴发生了取代反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com