
【题目】已知298K时下列物质的溶度积
CH3COOAg | AgCl | AgCrO4 | AgS | |
Ksp | 2.3×10-3 | 1.77×10-10 | 1.12×10-12 | 6.7×10-15 |
下列说法正确的是( )
A.等体积浓度均为0.02molL-1的CH3COONa和AgNO3溶液混合能产生沉淀
B.浓度均为0.01molL-1的CrO42-和Cl-混合溶液中慢慢滴入AgNO3溶液时,CrO42-先沉淀
C.在CH3COOAg悬浊液中加入盐酸发生反应的离子方程式:CH3COOAg+H++C1-=CH3COOH+AgCl
D.298K时,上述四种饱和溶液的物质的量浓度:c(CH3COOAg)>c(AgCl)>c(Ag2CrO4)>c(Ag2S)
【答案】C
【解析】
A、浓度熵QC=c(CH3COO-)c(Ag+)=0.01×0.01=1×10-4,KSP(CH3COOAg)=2.3×10-3,QC<KSP,所以溶液混合不能产生沉淀,故A错误;
B、AgCl饱和所需Ag+浓度c(Ag+)=![]() =
=![]() mol/L=1.77×10-8 mol/L;Ag2CrO4饱和所需Ag+浓度c(Ag+)=
mol/L=1.77×10-8 mol/L;Ag2CrO4饱和所需Ag+浓度c(Ag+)=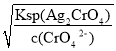 =
=![]() mol/L=1.1×10-5 mol/L,则1.77×10-8 mol/L<1.1×10-5 mol/L),所以Cl-先沉淀,故B错误;
mol/L=1.1×10-5 mol/L,则1.77×10-8 mol/L<1.1×10-5 mol/L),所以Cl-先沉淀,故B错误;
C、CH3COOAg沉淀的溶度积大于AgCl沉淀的溶度积,所以CH3COOAg+H++C1-=CH3COOH+AgCl,故C正确;
D、因为CH3COOAg饱和溶液中Ag+的浓度为![]() molL-1=0.48×10-2molL-1,所以c(CH3COOAg)=0.48×10-2molL-1;因为AgCl饱和溶液中Ag+的浓度为
molL-1=0.48×10-2molL-1,所以c(CH3COOAg)=0.48×10-2molL-1;因为AgCl饱和溶液中Ag+的浓度为![]() =1.33×10-5molL-1,所以c(AgCl)=1.33×10-5molL-1;假设Ag2CrO4饱和溶液中Ag+的浓度为x,则CrO42-的浓度为0.5x,由溶度积常数的表达式可知Ksp(Ag2CrO4)=x2×0.5x=0.5x3=1.12×10-12,x3=2.24×10-12,即x=
=1.33×10-5molL-1,所以c(AgCl)=1.33×10-5molL-1;假设Ag2CrO4饱和溶液中Ag+的浓度为x,则CrO42-的浓度为0.5x,由溶度积常数的表达式可知Ksp(Ag2CrO4)=x2×0.5x=0.5x3=1.12×10-12,x3=2.24×10-12,即x=![]() =1.3×10-4molL-1,所以c(Ag2CrO4)=0.65×10-4molL-1;假设Ag2S饱和溶液中Ag+的浓度为x,则S2-的浓度为0.5x,由溶度积常数的表达式可知Ksp(Ag2S)=x2×0.5x=0.5x3=6.7×10-15,x3=13.4×10-15,即x=2.38×10-5molL-1,所以c(Ag2S)=1.19×10-5molL-1。则顺序为:c(CH3COOAg)>c(Ag2CrO4)>c(AgCI)>c(Ag2S),故D错误;故选C。
=1.3×10-4molL-1,所以c(Ag2CrO4)=0.65×10-4molL-1;假设Ag2S饱和溶液中Ag+的浓度为x,则S2-的浓度为0.5x,由溶度积常数的表达式可知Ksp(Ag2S)=x2×0.5x=0.5x3=6.7×10-15,x3=13.4×10-15,即x=2.38×10-5molL-1,所以c(Ag2S)=1.19×10-5molL-1。则顺序为:c(CH3COOAg)>c(Ag2CrO4)>c(AgCI)>c(Ag2S),故D错误;故选C。


科目:高中化学 来源: 题型:
【题目】某同学设计一个电池(如图所示),探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
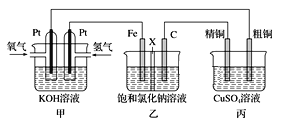
(1)通入氢气的电极为________ (填正极或负极),该电极反应式为________。
(2)石墨电极为________ (填阳极或阴极),乙中总反应离子方程式为________;如果把铁电极和石墨电极交换,乙溶液左侧出现的现象是__________________________________。
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将__________(填“增大”“减小”或“不变”)。
(4)若甲中消耗0.01mol O2,丙中精铜增重_________克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将2molSO2和1molO2置于10L密闭容器中发生反应:2SO2(g)+O2(g) ![]() 2SO3(g);ΔH<0,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是
2SO3(g);ΔH<0,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是
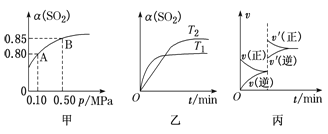
A.由图甲推断,B点SO2的平衡浓度为0.3 mol·L-1
B.由图甲推断,A点对应温度下该反应的平衡常数为800L·mol-1
C.压强为0.50 MPa时不同温度下SO2转化率与温度关系如乙图,则T2>T1
D.达平衡后,若增大容器容积,则反应速率变化图像可以用图丙表示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
A.升高温度,水的离子积增大
B.![]() 气体受压缩后,气体颜色先加深,后略变浅
气体受压缩后,气体颜色先加深,后略变浅
C.![]() ,
,![]() ,HIg的平衡体系,压缩容器体积,气体色变深
,HIg的平衡体系,压缩容器体积,气体色变深
D.![]() 中加入
中加入![]() 溶液,溶液颜色变浅
溶液,溶液颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某 500 mL 溶液中只可能含有 Na+、NH4+、Mg2+、Al3+、Fe2+、Fe3+、Cl-、![]() 、
、![]() 中 的几种离子。
中 的几种离子。
已知:NH4++OH-=NH3↑ +H2O
(1)取该溶液l00 mL,逐滴加入足量的NaOH溶液并加热,生成标准状况下的气体体积为 896 mL(气体已全部逸出),滴加过程中无沉淀生成。则该溶液中一定不含有的阳离子是______.
(2)另取100 mL原溶液于试管中,滴加足量的BaCl2溶液,生成白色沉淀6.27 g,再加入足量稀盐酸,沉淀部分溶解,生成标准状况下的气体体积为448 mL。则原浓液中下列离子的浓度:
离子种类 | 离子浓度 |
| ①___molL-1 |
| ②___ molL-1 |
Na+ | ③__molL-1 |
写出加入盐酸时,生成气体的离子方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,发生反应NH2COONH4 (s)![]() 2NH3 (g)+ CO2 (g) 。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是
2NH3 (g)+ CO2 (g) 。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是
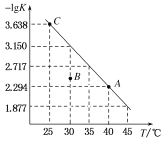
A.NH3的体积分数不变时,该反应一定达到平衡状态
B.该反应的△H>0
C.30 ℃时,B点对应状态的v(正)<v(逆)
D.C点对应状态的平衡常数K(C)=10-3.638
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为发光二极管连接柠檬电池装置,下列说法正确的是

A. 铁环作为柠檬电池的正极
B. 电子由发光二极管经导线流向Fe环
C. 负极的电极反应为:Fe-2 e-===Fe2+
D. 可将柠檬替换成盛装酒精溶液的装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F、G都是元素周期表中短周期主族元素,它们的原子序数依次增大。A是元素周期表中原子半径最小的元素,D3B中阴、阳离子具有相同的电子层结构,B原子最外电子层的p能级处于半满状态,C原子最外层的p能级电子数是s能级电子数的2倍,C、F处于同一主族,E最外层电子数比最内层多1。回答下列问题:
(1)E元素基态原子的电子排布式为___。
(2)用电子排布图表示F元素原子的价电子排布:____。
(3)F、G元素对应的最高价含氧酸中酸性较强的是___(填化学式)。
(4)离子半径:D+___(填“<”“>”或“=”,下同)B3-,第一电离能:B___C,电负性:C__F。
(5)A、C形成的一种绿色氧化剂X有广泛应用,X分子中A、C原子个数比为1∶1,X的电子式为___。试写出Cu、稀硫酸与X反应制备硫酸铜的离子方程式:__。
(6)写出E的单质与D的最高价氧化物对应的水化物反应的化学方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BMO(Bi2MoO6)是一种高效光催化剂,可用于光催化降解苯酚,原理如图所示。下列说法不正确的是

A. 该过程的总反应:C6H6O+7O2![]() 6CO2+3H2O
6CO2+3H2O
B. 该过程中BMO表现较强氧化性
C. 降解产物的分子中只含有极性共价键
D. ①和②中被降解的苯酚的物质的量之比为3:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com