
ЁОЬтФПЁПвбжЊAЁЂBЁЂCЁЂDЁЂEЁЂFЁЂGЖМЪЧдЊЫижмЦкБэжаЖЬжмЦкжїзхдЊЫиЃЌЫќУЧЕФдзгађЪ§вРДЮдіДѓЁЃAЪЧдЊЫижмЦкБэжадзгАыОЖзюаЁЕФдЊЫиЃЌD3BжавѕЁЂбєРызгОпгаЯрЭЌЕФЕчзгВуНсЙЙЃЌBдзгзюЭтЕчзгВуЕФpФмМЖДІгкАыТњзДЬЌЃЌCдзгзюЭтВуЕФpФмМЖЕчзгЪ§ЪЧsФмМЖЕчзгЪ§ЕФ2БЖЃЌCЁЂFДІгкЭЌвЛжїзхЃЌEзюЭтВуЕчзгЪ§БШзюФкВуЖр1ЁЃЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉEдЊЫиЛљЬЌдзгЕФЕчзгХХВМЪНЮЊ___ЁЃ
ЃЈ2ЃЉгУЕчзгХХВМЭМБэЪОFдЊЫидзгЕФМлЕчзгХХВМЃК____ЁЃ
ЃЈ3ЃЉFЁЂGдЊЫиЖдгІЕФзюИпМлКЌбѕЫсжаЫсадНЯЧПЕФЪЧ___(ЬюЛЏбЇЪН)ЁЃ
ЃЈ4ЃЉРызгАыОЖЃКD+___(ЬюЁА<ЁБЁА>ЁБЛђЁАЃНЁБЃЌЯТЭЌ)B3-ЃЌЕквЛЕчРыФмЃКB___CЃЌЕчИКадЃКC__FЁЃ
ЃЈ5ЃЉAЁЂCаЮГЩЕФвЛжжТЬЩЋбѕЛЏМСXгаЙуЗКгІгУЃЌXЗжзгжаAЁЂCдзгИіЪ§БШЮЊ1ЁУ1ЃЌXЕФЕчзгЪНЮЊ___ЁЃЪдаДГіCuЁЂЯЁСђЫсгыXЗДгІжЦБИСђЫсЭЕФРызгЗНГЬЪНЃК__ЁЃ
ЃЈ6ЃЉаДГіEЕФЕЅжЪгыDЕФзюИпМлбѕЛЏЮяЖдгІЕФЫЎЛЏЮяЗДгІЕФЛЏбЇЗНГЬЪНЃК____ЁЃ
ЁОД№АИЁП1s22s22p63s23p1 ![]() HClO4 < > >
HClO4 < > > ![]() Cu+2H++H2O2=Cu2++2H2O 2Al+2H2O+2NaOH=2NaAlO2+3H2Ёќ
Cu+2H++H2O2=Cu2++2H2O 2Al+2H2O+2NaOH=2NaAlO2+3H2Ёќ
ЁОНтЮіЁП
![]() ЁЂ
ЁЂ![]() ЁЂ
ЁЂ![]() ЁЂ
ЁЂ![]() ЁЂ
ЁЂ![]() ЁЂ
ЁЂ![]() ЁЂ
ЁЂ![]() ЖМЪЧдЊЫижмЦкБэжаЖЬжмЦкжїзхдЊЫиЃЌЫќУЧЕФдзгађЪ§вРДЮдіДѓЃЌ
ЖМЪЧдЊЫижмЦкБэжаЖЬжмЦкжїзхдЊЫиЃЌЫќУЧЕФдзгађЪ§вРДЮдіДѓЃЌ![]() ЪЧжмЦкБэжадзгАыОЖзюаЁЕФдЊЫиЃЌдђ
ЪЧжмЦкБэжадзгАыОЖзюаЁЕФдЊЫиЃЌдђ ![]() ЪЧ
ЪЧ ![]() дЊЫиЃЌ
дЊЫиЃЌ![]() жавѕЁЂбєРызгОпгаЯрЭЌЕФЕчзгВуНсЙЙЃЌ
жавѕЁЂбєРызгОпгаЯрЭЌЕФЕчзгВуНсЙЙЃЌ![]() дзгзюЭтЕчзгВуЕФ
дзгзюЭтЕчзгВуЕФ ![]() ФмМЖЩЯЕФЕчзгДІгкАыТњзДЬЌЃЌЮЊЕкVA зхдЊЫиЃЌ
ФмМЖЩЯЕФЕчзгДІгкАыТњзДЬЌЃЌЮЊЕкVA зхдЊЫиЃЌ![]() ЮЊ
ЮЊ ![]() МлЁЂ
МлЁЂ![]() ЮЊ
ЮЊ ![]() МлЧв
МлЧв ![]() ЪЧН№ЪєдЊЫиЃЌ
ЪЧН№ЪєдЊЫиЃЌ![]() ЕФдзгађЪ§Дѓгк
ЕФдзгађЪ§Дѓгк ![]() ЁЂ
ЁЂ![]() ЃЌдђ
ЃЌдђ ![]() ЮЊ
ЮЊ ![]() дЊЫиЁЂ
дЊЫиЁЂ![]() ЮЊ
ЮЊ ![]() дЊЫиЃЌCдзгзюЭтВуЕФpФмМЖЕчзгЪ§ЪЧsФмМЖЕчзгЪ§ЕФ2БЖЃЌдђ
дЊЫиЃЌCдзгзюЭтВуЕФpФмМЖЕчзгЪ§ЪЧsФмМЖЕчзгЪ§ЕФ2БЖЃЌдђ ![]() ЪЧ
ЪЧ ![]() дЊЫиЃЌ
дЊЫиЃЌ![]() ЁЂ
ЁЂ![]() ЪєЭЌвЛжїзхЃЌдђ
ЪєЭЌвЛжїзхЃЌдђ ![]() ЪЧ
ЪЧ ![]() дЊЫиЃЌ
дЊЫиЃЌ![]() зюЭтВуЕчзгЪ§БШзюФкВуЖр
зюЭтВуЕчзгЪ§БШзюФкВуЖр ![]() ЃЌдђ
ЃЌдђ ![]() зюЭтВуЕчзгЪ§ЮЊ
зюЭтВуЕчзгЪ§ЮЊ ![]() ЃЌ
ЃЌ![]() ЪЧ
ЪЧ ![]() дЊЫиЃЌ
дЊЫиЃЌ![]() ЕФдзгађЪ§Дѓгк
ЕФдзгађЪ§Дѓгк ![]() ЃЌЧвЮЊЖЬжмЦкжїзхдЊЫиЃЌдђ
ЃЌЧвЮЊЖЬжмЦкжїзхдЊЫиЃЌдђ ![]() ЪЧ
ЪЧ ![]() дЊЫиЁЃ
дЊЫиЁЃ
ЃЈ1ЃЉЭЈЙ§вдЩЯЗжЮіжЊЃЌ![]() ЪЧ
ЪЧ ![]() дЊЫиЃЌЦфдзгКЫЭтга 13 ИіЕчзгЃЌИљОнЙЙдьдРэжЊЦфЛљЬЌдзгКЫЭтЕчзгХХВМЪНЮЊ
дЊЫиЃЌЦфдзгКЫЭтга 13 ИіЕчзгЃЌИљОнЙЙдьдРэжЊЦфЛљЬЌдзгКЫЭтЕчзгХХВМЪНЮЊ ![]() ЁЃ
ЁЃ
ЃЈ2ЃЉ![]() ЮЊ
ЮЊ ![]() дЊЫиЃЌЦфМлЕчзгЮЊ
дЊЫиЃЌЦфМлЕчзгЮЊ ![]() ЁЂ
ЁЂ![]() ЕчзгЃЌЦфМлЕчзгХХВМЭМЮЊ
ЕчзгЃЌЦфМлЕчзгХХВМЭМЮЊ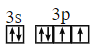 ЁЃ
ЁЃ
ЃЈ3ЃЉдЊЫиЕФЗЧН№ЪєаддНЧПЃЌЦфзюИпМлбѕЛЏЮяЕФЫЎЛЏЮяЫсаддНЧПЃЌ![]() дЊЫиЕФЗЧН№ЪєадДѓгк
дЊЫиЕФЗЧН№ЪєадДѓгк ![]() дЊЫиЃЌдђ
дЊЫиЃЌдђ ![]() дЊЫиЖдгІЕФзюИпМлКЌбѕЫсжаЫсадНЯЧПЕФЗжзгЪНЮЊ
дЊЫиЖдгІЕФзюИпМлКЌбѕЫсжаЫсадНЯЧПЕФЗжзгЪНЮЊ ![]() ЁЃ
ЁЃ
ЃЈ4ЃЉЕчзгВуНсЙЙЯрЭЌЕФРызгЃЌРызгАыОЖЫцзХдзгађЪ§ЕФдіДѓЖјМѕаЁЃЌЫљвдРызгАыОЖ ![]() ЃЌ
ЃЌ![]() ЪЧ
ЪЧ ![]() дЊЫиЁЂ
дЊЫиЁЂ![]() ЪЧ
ЪЧ ![]() дЊЫиЃЌЭЌвЛжмЦкдЊЫижаЃЌдЊЫиЕквЛЕчРыФмЫцзХдзгађЪ§ЕФдіДѓЖјГЪдіДѓЧїЪЦЃЌЕЋЕкЂѕ
дЊЫиЃЌЭЌвЛжмЦкдЊЫижаЃЌдЊЫиЕквЛЕчРыФмЫцзХдзгађЪ§ЕФдіДѓЖјГЪдіДѓЧїЪЦЃЌЕЋЕкЂѕ![]() зхдЊЫиЕквЛЕчРыФмДѓгкЯрСкдЊЫиЃЌЫљвдЕквЛЕчРыФм
зхдЊЫиЕквЛЕчРыФмДѓгкЯрСкдЊЫиЃЌЫљвдЕквЛЕчРыФм ![]() ЃЛ
ЃЛ![]() ЪЧ
ЪЧ ![]() дЊЫиЁЂ
дЊЫиЁЂ![]() ЪЧ
ЪЧ ![]() дЊЫиЃЌЭЌвЛжїзхдЊЫижаЃЌЕчИКадЫцзХдзгађЪ§ЕФдіДѓЖјМѕаЁЃЌЫљвдЕчИКад
дЊЫиЃЌЭЌвЛжїзхдЊЫижаЃЌЕчИКадЫцзХдзгађЪ§ЕФдіДѓЖјМѕаЁЃЌЫљвдЕчИКад ![]() ЁЃ
ЁЃ
ЃЈ5ЃЉ![]() ЁЂ
ЁЂ![]() аЮГЩЕФвЛжжТЬЩЋбѕЛЏМС
аЮГЩЕФвЛжжТЬЩЋбѕЛЏМС ![]() гаЙуЗКгІгУЃЌ
гаЙуЗКгІгУЃЌ![]() Зжзгжа
Зжзгжа ![]() ЁЂ
ЁЂ![]() дзгИіЪ§БШ 1:1ЃЌдђ
дзгИіЪ§БШ 1:1ЃЌдђ ![]() ЪЧЫЋбѕЫЎЃЌЦфЕчзгЪНЮЊ
ЪЧЫЋбѕЫЎЃЌЦфЕчзгЪНЮЊ![]()
![]() ЃЌЫсадЬѕМўЯТЃЌЫЋбѕЫЎНЋЭбѕЛЏЮЊЭРызгЃЌРызгЗНГЬЪНЮЊ
ЃЌЫсадЬѕМўЯТЃЌЫЋбѕЫЎНЋЭбѕЛЏЮЊЭРызгЃЌРызгЗНГЬЪНЮЊ ![]() ЁЃ
ЁЃ
ЃЈ6ЃЉ![]() ЕФзюИпМлбѕЛЏЮяЕФЫЎЛЏЮяЪЧ
ЕФзюИпМлбѕЛЏЮяЕФЫЎЛЏЮяЪЧ ![]() ЃЌТСКЭЧтбѕЛЏФЦШмвКЗДгІЩњГЩЦЋТСЫсФЦКЭЧтЦјЃЌЗДгІЗНГЬЪНЪНЮЊ
ЃЌТСКЭЧтбѕЛЏФЦШмвКЗДгІЩњГЩЦЋТСЫсФЦКЭЧтЦјЃЌЗДгІЗНГЬЪНЪНЮЊ ![]() ЁЃ
ЁЃ


 ЪюМйзївЕКЃбрГіАцЩчЯЕСаД№АИ
ЪюМйзївЕКЃбрГіАцЩчЯЕСаД№АИ БОЭСНЬИЈгЎдкЪюМйИпаЇМйЦкзмИДЯАдЦФЯПЦММГіАцЩчЯЕСаД№АИ
БОЭСНЬИЈгЎдкЪюМйИпаЇМйЦкзмИДЯАдЦФЯПЦММГіАцЩчЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПТШЫсУО![]() ГЃгУзїДпЪьМСЁЂГ§ВнМСЕШЃЌЪЕбщЪвжЦБИЩйСП
ГЃгУзїДпЪьМСЁЂГ§ВнМСЕШЃЌЪЕбщЪвжЦБИЩйСП![]() ЕФСїГЬШчЭМ1ЃК
ЕФСїГЬШчЭМ1ЃК
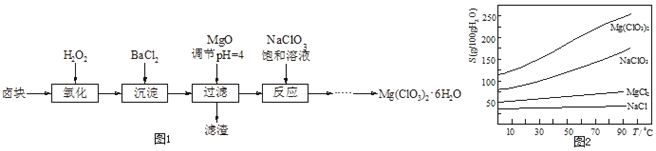
вбжЊЃК
![]() ТБПщжївЊГЩЗжЮЊ
ТБПщжївЊГЩЗжЮЊ![]() ЃЌКЌга
ЃЌКЌга![]() ЁЂ
ЁЂ![]() ЕШдгжЪЃЛ
ЕШдгжЪЃЛ
![]() МИжжЛЏКЯЮяЕФШмНтЖШ
МИжжЛЏКЯЮяЕФШмНтЖШ![]() ЫцЮТЖШ
ЫцЮТЖШ![]() БфЛЏЧњЯпШчЭМ2ЃЎ
БфЛЏЧњЯпШчЭМ2ЃЎ
![]() МгMgOКѓЙ§ТЫЫљЕУТЫдќЕФжївЊГЩЗжЮЊ______ЃЎ
МгMgOКѓЙ§ТЫЫљЕУТЫдќЕФжївЊГЩЗжЮЊ______ЃЎ
![]() МгШы
МгШы![]() ЕФФПЕФЪЧГ§ШЅ
ЕФФПЕФЪЧГ§ШЅ![]() ЃЌШчКЮМьбщ
ЃЌШчКЮМьбщ![]() вбГСЕэЭъШЋ______ЃЎ
вбГСЕэЭъШЋ______ЃЎ
![]() МгШы
МгШы![]() БЅКЭШмвКЛсЗЂЩњШчЯТЗДгІЃК
БЅКЭШмвКЛсЗЂЩњШчЯТЗДгІЃК![]() ЃЌЧыРћгУИУЗДгІЃЌНсКЯЭМ1ЃЌжЦШЁ
ЃЌЧыРћгУИУЗДгІЃЌНсКЯЭМ1ЃЌжЦШЁ![]() ЕФЪЕбщВНжшвРДЮЮЊЃК
ЕФЪЕбщВНжшвРДЮЮЊЃК
![]() ШЁбљЃЌМгШы
ШЁбљЃЌМгШы![]() БЅКЭШмвКГфЗжЗДгІЃЛ
БЅКЭШмвКГфЗжЗДгІЃЛ
![]() ______ЃЛ
______ЃЛ
![]() ______ЃЛ
______ЃЛ
![]() ______ЃЛ
______ЃЛ
![]() Й§ТЫЁЂЯДЕгЃЌЛёЕУ
Й§ТЫЁЂЯДЕгЃЌЛёЕУ![]() ОЇЬхЃЎ
ОЇЬхЃЎ
ВњЦЗжа![]() КЌСПЕФВтЖЈЃК
КЌСПЕФВтЖЈЃК
ВНжш1ЃКзМШЗГЦСП![]() ВњЦЗШмНтЖЈШнГЩ100mLШмвКЃЎ
ВњЦЗШмНтЖЈШнГЩ100mLШмвКЃЎ
ВНжш2ЃКШЁ10mLгкзЖаЮЦПжаЃЌМгШы10mLЯЁСђЫсКЭ![]() ЕФ
ЕФ![]() ШмвКЃЌЮЂШШЃЎ
ШмвКЃЌЮЂШШЃЎ
ВНжш3ЃКРфШДжСЪвЮТЃЌгУ![]() ШмвКЕЮЖЈжСжеЕуЃЌДЫЙ§ГЬжаЗДгІЕФРызгЗНГЬЪНЮЊЃК
ШмвКЕЮЖЈжСжеЕуЃЌДЫЙ§ГЬжаЗДгІЕФРызгЗНГЬЪНЮЊЃК![]()
ВНжш4ЃКНЋВНжш2ЁЂ3жиИДСНДЮЃЌЦНОљЯћКФ![]() ШмвК
ШмвК![]() ЃЎ
ЃЎ
![]() ЩЯЪіВњЦЗВтЖЈжаашвЊМьВщЪЧЗёТЉвКЕФвЧЦїга______
ЩЯЪіВњЦЗВтЖЈжаашвЊМьВщЪЧЗёТЉвКЕФвЧЦїга______![]() ВНжш3жаШєЕЮЖЈЧАВЛгУБъзМвКШѓЯДЕЮЖЈЙмЃЌЛсЕМжТзюжеНсЙћЦЋ______
ВНжш3жаШєЕЮЖЈЧАВЛгУБъзМвКШѓЯДЕЮЖЈЙмЃЌЛсЕМжТзюжеНсЙћЦЋ______![]() ЬюЁАДѓЁБЛђЁАаЁЁБ
ЬюЁАДѓЁБЛђЁАаЁЁБ![]() ЃЎ
ЃЎ
![]() ВњЦЗжа
ВњЦЗжа![]() ЕФжЪСПЗжЪ§ЮЊ______
ЕФжЪСПЗжЪ§ЮЊ______![]() МЦЫуНсЙћБЃСєСНЮЛаЁЪ§
МЦЫуНсЙћБЃСєСНЮЛаЁЪ§![]()
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГЛЏбЇаЁзщЩшМЦСЫШчЭМЫљЪОЕФЪ§зжЛЏЪЕбщзАжУЃЌбаОПГЃЮТЯТЃЌЯђ1L0.1mol/L H2AШмвКжаж№ЕЮМгШыЕШХЈЖШNaOHШмвКЪБЕФpHБфЛЏЧщПіЃЌВЂЛцжЦГіШмвКжаКЌAдЊЫиЕФЮЂСЃЕФЮяжЪЕФСПЗжЪ§гыШмвКpHЕФЙиЯЕШчЭМЫљЪОЃЌдђЯТСаЫЕЗЈжаВЛе§ШЗЕФЪЧЃЈ ЃЉ
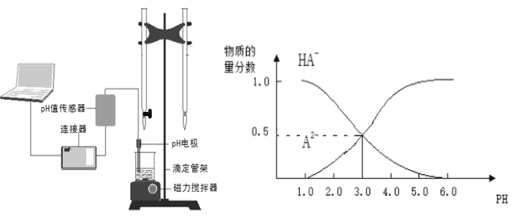
AЃЎpH=4.0ЪБЃЌЭМжаn(HAЃ)дМЮЊ0.0091mol
BЃЎИУЪЕбщгІНЋзѓБпЕФЫсЪНЕЮЖЈЙмЛЛГЩгвБпМюЪНЕЮЖЈЙмВЂМгЗгЬЊзїжИЪОМС
CЃЎГЃЮТЯТЃЌЕШЮяжЪЕФСПХЈЖШЕФNaHAгыNa2AШмвКЕШЬхЛ§ЛьКЯКѓШмвКpH=3.0
DЃЎ0.1mol/LNaHAШмвКжаДцдкc(A2Ѓ)ЃЋc(HAЃ)ЃЋc(H2A)ЃН0.1mol/L
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдквЛУмБеШнЦїжаЃЌЗДгІaAЃЈgЃЉЈPbBЃЈgЃЉДяЦНКтКѓЃЌБЃГжЮТЖШВЛБфЃЌНЋШнЦїЬхЛ§діМгвЛБЖЃЌЕБДяЕНаТЕФЦНКтЪБЃЌBЕФХЈЖШЪЧдРДЕФ60%ЃЌдђЃЈ ЃЉ
A.ЦНКтЯђе§ЗДгІЗНЯђвЦЖЏСЫB.ЮяжЪAЕФзЊЛЏТЪМѕЩйСЫ
C.ЮяжЪBЕФжЪСПЗжЪ§МѕаЁСЫD.a>b
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПбѕКЭСђЕФЛЏКЯЮядкЛЏЙЄЩњВњЩЯгІгУЗЧГЃЙуЗК.ЪдЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉГєбѕМИКѕПЩгыçЁЂН№ЁЂвПЁЂЗњвдЭтЕФЫљгаЕЅжЪЗДгІЁЃ
МКжЊЃК6AgЃЈsЃЉ+O3ЃЈgЃЉЈT3Ag2OЃЈsЃЉЃЛЁїH=Љ235kJ/molЃЛ
2Ag2OЃЈsЃЉЈT4AgЃЈsЃЉ+O2ЃЈgЃЉЃЛЁїH=+60kJ/molЃЛ
дђЗДгІ2O3ЃЈgЃЉ=3O2ЃЈgЃЉЕФЁїH=___ЁЃ
ЃЈ2ЃЉSO2Cl2ГЃгУгкжЦдьвНвЉЦЗЁЂШОСЯЁЂБэУцЛюадМСЕШ.вбжЊЃКSO2Cl2ЃЈgЃЉ![]() SO2ЃЈgЃЉ+Cl2ЃЈgЃЉЁїH=akJmolЉ1ЁЃ300ЁцЪБЯђЬхЛ§ЮЊ2LЕФКуШнУмБеШнЦїжаГфШы0.20molSO2Cl2ЃЌДяЕНЦНКтЪБЃЌШнЦїжаКЌ0.1molSO2ЃЌИУЮТЖШЪБЗДгІЕФЦНКтГЃЪ§ЮЊ___ЁЃНЋЩЯЪіЫљЕУЛьКЯЦјЬхШмгкзуСПBaCl2ШмвКжаЃЌзюжеЩњГЩГСЕэЕФжЪСПЮЊ___ЁЃ
SO2ЃЈgЃЉ+Cl2ЃЈgЃЉЁїH=akJmolЉ1ЁЃ300ЁцЪБЯђЬхЛ§ЮЊ2LЕФКуШнУмБеШнЦїжаГфШы0.20molSO2Cl2ЃЌДяЕНЦНКтЪБЃЌШнЦїжаКЌ0.1molSO2ЃЌИУЮТЖШЪБЗДгІЕФЦНКтГЃЪ§ЮЊ___ЁЃНЋЩЯЪіЫљЕУЛьКЯЦјЬхШмгкзуСПBaCl2ШмвКжаЃЌзюжеЩњГЩГСЕэЕФжЪСПЮЊ___ЁЃ
ЃЈ3ЃЉЖдЃЈ2ЃЉжаЕФЗДгІЃЌдк400ЁцЃЌ1.01ЁС105PaЬѕМўЯТЃЌЯђШнЛ§ЮЊ2LЕФКуШнУмБеШнЦїжаГфШывЛЖЈСПЕФSO2Cl2ЃЌnЃЈSO2ЃЉКЭnЃЈSO2Cl2ЃЉЫцЪБМфЕФБфЛЏЧњЯпШчЭМЫљЪОЁЃ
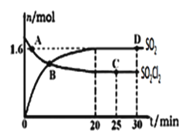
Ђй0ЁЋ20minЗДгІЕФЦНОљЫйТЪvЃЈSO2Cl2ЃЉ=___ЁЃЁїH___0(ЬюЁА<ЁБЁА>ЁБЛђЁАЃНЁБ)ЦфдвђЪЧЃК___ЁЃ
ЂкЯТСаа№Ъіе§ШЗЕФЪЧ___ЁЃ
A.AЕуvе§ЃЈSO2Cl2ЃЉЃОvФцЃЈSO2Cl2ЃЉ
B.УмЖШКЭЦНОљФІЖћжЪСПВЛБфОљЫЕУїДІгкЦНКтзДЬЌ
C.ЦфЫќЬѕМўВЛБфЃЌШєдіДѓбЙЧПЃЌnЃЈSO2ЃЉБШЭМжаDЕуЕФжЕДѓ
D.ЦфЫќЬѕМўВЛБфЃЌ500ЁцЪБЗДгІДяЦНКтЃЌnЃЈSO2ЃЉБШЭМжаDЕуЕФжЕДѓ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯжНЋ1.92gCuЭЖШыЕНвЛЖЈСПЕФХЈHNO3жаЃЌCuЭъШЋШмНтЃЌЩњГЩЦјЬхбеЩЋдНРДдНЧГЃЌЙВЪеМЏЕНБъзМзДПіЯТ672mLЕФNOXЛьКЯЦјЬхЃЌНЋЪЂгаДЫЦјЬхЕФШнЦїЕЙПлдкЫЎВлжаЃЌЭЈШыБъзМзДПіЯТвЛЖЈЬхЛ§ЕФO2ЃЌЧЁКУЪЙЦјЬхЭъШЋШмгкЫЎЃЌдђЭЈШыБъзМзДПіЯТЕФO2ЕФЬхЛ§ЮЊЃЈ ЃЉ
A. 504mLB. 336mLC. 224mLD. 168mL
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПГЃЮТЯТЃЌгУ![]() ШмвКЃЌЗжБ№ЕЮЖЈ
ШмвКЃЌЗжБ№ЕЮЖЈ![]() ХЈЖШОљЮЊ
ХЈЖШОљЮЊ![]() ШмвККЭHCNШмвКЃЌЫљЕУЕЮЖЈЧњЯпШчЭМЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ
ШмвККЭHCNШмвКЃЌЫљЕУЕЮЖЈЧњЯпШчЭМЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ![]()

A.Еу![]() КЭЕу
КЭЕу![]() ЫљЪОШмвКжаЃК
ЫљЪОШмвКжаЃК![]()
B.ДзЫсЕФЕЮЖЈжеЕуЪЧ![]()
C.ЕЮЖЈ![]() Й§ГЬжаВЛПЩФмГіЯжЃК
Й§ГЬжаВЛПЩФмГіЯжЃК![]()
D.ЕЮЖЈHCNЙ§ГЬжаПЩвдгУЗгЬЊЪдвКжИЪОжеЕу
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЗДгІ2SO2 + O2 ![]() 2SO3ЪЧЙЄвЕЩњВњСђЫсЕФЙиМќВНжшЃЌЯТСаЫЕЗЈВЛе§ШЗЕФ
2SO3ЪЧЙЄвЕЩњВњСђЫсЕФЙиМќВНжшЃЌЯТСаЫЕЗЈВЛе§ШЗЕФ
A.ЪЕМЪЩњВњжаЃЌДЫЗДгІдкНгДЅЪвНјаа
B.Й§СППеЦјФмЬсИпSO2ЕФзЊЛЏТЪ
C.ЪЙгУДпЛЏМСФмЬсИпИУЗДгІЕФЗДгІЫйТЪ
D.2molSO2гы1molO2ЛьКЯвЛЖЈФмЩњГЩ2molSO3
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПжмЦкБэЧАЫФжмЦкЕФдЊЫиaЁЂbЁЂcЁЂdЁЂeЃЌдзгађЪ§вРДЮдіДѓЃЌaКЭbЪЧзщГЩЮяжЪжжРрзюЖрЕФдЊЫиЃЌcЪЧЕиПЧжаКЌСПзюЖрЕФдЊЫиЃЌdгыbЭЌзхЃЌe2+РызгЕФ3dЙьЕРжага9ИіЕчзгЁЃЛиД№ЯТСаЮЪЬтЃК
(1)cЁЂdСНжждЊЫиаЮГЩЕФЛЏКЯЮяЭГГЦЙшЪЏЃЌПЩЭЈЙ§______________ЗНЗЈЧјЗжЦфНсОЇаЮКЭЮоЖЈаЮЕФСНжжДцдкаЮЬЌЃЌcЕФМлЕчзгХХВМЭМЮЊ______________________________ЁЃ
(2)AКЭBЪЧЩњЛюжаСНжжГЃМћЕФгаЛњЮяЃЌAФмгыCaCO3ЗДгІЃЌПЩгУгкГјЗПГ§ЫЎЙИЃЛBЗжзгжаЕФЬМдзгЪ§ФПгыAжаЯрЭЌЃЌПЩгыФЦЗДгІЗХГіЦјЬхЁЃBжаДцдкЕФЛЏбЇМќРраЭЪЧ______ЃЛ
A.РызгМќ B.ЙВМлМќ C.Н№ЪєМќ D.ЧтМќ
AЗжзгжаЬМдзгЕФЙьЕРдгЛЏРраЭЪЧ___________ЁЃ
(3)гУЁА>ЁБЛђЁА<ЁБЬюПеЃК
ЕквЛЕчРыФм | ШлЕу |
b___d | dc2ОЇЬх___dОЇЬх |
(4)cгыeСНжждЊЫиПЩаЮГЩвЛжжАыЕМЬхВФСЯЃЌЛЏбЇЪНЮЊe2cЃЌдкЦфСЂЗНОЇАћФкВПгаЫФИіcдзгЃЌЦфгрcдзгЮЛгкУцаФКЭЖЅЕуЃЌдђИУОЇАћжага____ИіeдзгЁЃ
(5)Яђe2+СђЫсбЮЕФЫЎШмвКжаМгШыЙ§СПЕФАБЫЎЃЌПЩЕУЕНЩюРЖЩЋЭИУїШмвКЃЌаДГіЩњГЩХфРызгЕФНсЙЙ______________(вЊЧѓЛГіХфЮЛМќ)ЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com