
【题目】反应2SO2 + O2 ![]() 2SO3是工业生产硫酸的关键步骤,下列说法不正确的
2SO3是工业生产硫酸的关键步骤,下列说法不正确的
A.实际生产中,此反应在接触室进行
B.过量空气能提高SO2的转化率
C.使用催化剂能提高该反应的反应速率
D.2molSO2与1molO2混合一定能生成2molSO3
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.01 mol/L CH3COOH溶液中逐滴加入0.01 mol/L 的NaOH溶液,溶液中水所电离出的c(H+)随加入NaOH溶液的体积变化示意图如下,下列说法正确的是
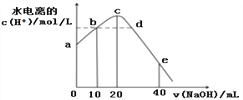
A. 从a到c,对醋酸的电离既有促进作用也有抑制作用
B. b、d两点溶液的pH相同
C. e点所示溶液中,c(Na+)=2c(CH3COO-)+2c(CH3COOH) = 0.01mol/L
D. 从b→d的过程中,既存在pH=7的点也存在水电离的c(H+)=10-7的点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F、G都是元素周期表中短周期主族元素,它们的原子序数依次增大。A是元素周期表中原子半径最小的元素,D3B中阴、阳离子具有相同的电子层结构,B原子最外电子层的p能级处于半满状态,C原子最外层的p能级电子数是s能级电子数的2倍,C、F处于同一主族,E最外层电子数比最内层多1。回答下列问题:
(1)E元素基态原子的电子排布式为___。
(2)用电子排布图表示F元素原子的价电子排布:____。
(3)F、G元素对应的最高价含氧酸中酸性较强的是___(填化学式)。
(4)离子半径:D+___(填“<”“>”或“=”,下同)B3-,第一电离能:B___C,电负性:C__F。
(5)A、C形成的一种绿色氧化剂X有广泛应用,X分子中A、C原子个数比为1∶1,X的电子式为___。试写出Cu、稀硫酸与X反应制备硫酸铜的离子方程式:__。
(6)写出E的单质与D的最高价氧化物对应的水化物反应的化学方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
①可以用Cu(OH)2悬浊液用一种试剂鉴别甲酸、乙酸、乙醛、乙醇。
②可用酸性K2Cr2O7溶液检验是否酒后驾车,该应用利用了乙醇的还原性和低沸点的性质。
③向银氨溶液中加入几滴乙醛后用酒精灯加热至沸腾制可得银镜。
④向足量的浓苯酚溶液中滴入少量溴水,可观察到有白色沉淀生成,该沉淀为2,4,6-三溴苯酚。
⑤该分子 中的碳原子可能都在同一平面。
中的碳原子可能都在同一平面。
⑥做过银镜反应实验后的试管,用氨水洗涤。
A. ①②④⑤⑥ B. ①②③④ C. ①②④ D. ①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车。电池反应为:FePO4+Li![]() LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含U导电固体为电解质。下列有关LiFePO4电池说法正确的是( )
LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含U导电固体为电解质。下列有关LiFePO4电池说法正确的是( )
A. 可加入硫酸以提高电解质的导电性
B. 放电时电池内部Li+向负极移动.
C. 充电过程中,电池正极材料的质量减少
D. 放电时电池正极反应为:FePO4+Li++e-=LiFePO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 0.50 mol·L1盐酸与50 mL 0.55 mol·L1 NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是______________________________。
(2)烧杯间填满碎纸条的作用是______________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值__________(填”偏大”“偏小”或”无影响”)。
(4)实验中改用60 mL 0.50 mol·L1盐酸跟50 mL 0.55 mol·L1 NaOH溶液进行反应,与上述实验相比,所放出的热量__________(填”相等”或”不相等”),所求中和热__________(填”相等”或”不相等”),简述理由:_________________________。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会__________(填”偏大”“偏小”或”无影响”,下同);用50 mL 0.50 mol·L1 NaOH溶液进行上述实验,测得的中和热的数值会__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中和滴定实验是中学化学的重要实验之一。下列有关说法错误的是![]() 滴定过程的其他操作均正确
滴定过程的其他操作均正确![]()
A.滴定管洗净后,应用待装液润洗![]() 次
次
B.用![]() 酸式滴定管量取
酸式滴定管量取![]()
![]() 溶液
溶液
C.滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁
D.滴定前滴定管内无气泡,终点读数时有气泡,所滴加液体体积偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用某浓度NaOH溶液滴定一元酸HA的滴定曲线如图所示(横坐标为滴入NaOH的体积,纵坐标为所得混合液的pH;甲基橙变色范围为3.1~4.4)。下列判断正确的是
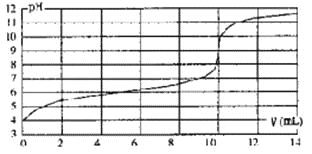
A.HA的浓度为l×10-4mol·L-1
B.实验时可选甲基橙作指示剂
C.V=10mL,酸碱恰好中和
D.pH=7时,溶液中c(Na+)>c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)把0.4 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:4 X(g)+5 Y(g) ![]() n Z(g)+6 W(g)。2 min 末已生成0.3 mol W,若测知以Z的浓度变化表示的反应速率为0.05 mol·(L·min)-1,计算:前2 min内用X的浓度变化表示的平均反应速率________化学反应方程式中n的值是______________________,2 min末时Y的浓度_____________________。
n Z(g)+6 W(g)。2 min 末已生成0.3 mol W,若测知以Z的浓度变化表示的反应速率为0.05 mol·(L·min)-1,计算:前2 min内用X的浓度变化表示的平均反应速率________化学反应方程式中n的值是______________________,2 min末时Y的浓度_____________________。
(2)已知有机物 HT 能将 Ce3+从水溶液中萃取出来,该过程可表示为:2Ce3+ (水层)+ 6HT(有机层)![]() 2CeT3 (有机层)+ 6H+(水层) 从平衡角度解释:向 CeT3 (有机层)加入 H2SO4 获得较纯的含 Ce3+的水溶液的原因是__________________________________。
2CeT3 (有机层)+ 6H+(水层) 从平衡角度解释:向 CeT3 (有机层)加入 H2SO4 获得较纯的含 Ce3+的水溶液的原因是__________________________________。
(3)硫酸铁铵矾[Fe2(SO4) 3·(NH4) 2SO4·24H2O]广泛用于水的净化处理,其净水原理用离子方程式解释是______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com