
【题目】(1)把0.4 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:4 X(g)+5 Y(g) ![]() n Z(g)+6 W(g)。2 min 末已生成0.3 mol W,若测知以Z的浓度变化表示的反应速率为0.05 mol·(L·min)-1,计算:前2 min内用X的浓度变化表示的平均反应速率________化学反应方程式中n的值是______________________,2 min末时Y的浓度_____________________。
n Z(g)+6 W(g)。2 min 末已生成0.3 mol W,若测知以Z的浓度变化表示的反应速率为0.05 mol·(L·min)-1,计算:前2 min内用X的浓度变化表示的平均反应速率________化学反应方程式中n的值是______________________,2 min末时Y的浓度_____________________。
(2)已知有机物 HT 能将 Ce3+从水溶液中萃取出来,该过程可表示为:2Ce3+ (水层)+ 6HT(有机层)![]() 2CeT3 (有机层)+ 6H+(水层) 从平衡角度解释:向 CeT3 (有机层)加入 H2SO4 获得较纯的含 Ce3+的水溶液的原因是__________________________________。
2CeT3 (有机层)+ 6H+(水层) 从平衡角度解释:向 CeT3 (有机层)加入 H2SO4 获得较纯的含 Ce3+的水溶液的原因是__________________________________。
(3)硫酸铁铵矾[Fe2(SO4) 3·(NH4) 2SO4·24H2O]广泛用于水的净化处理,其净水原理用离子方程式解释是______________________________________________。
【答案】0.05 mol·(L·min)-1 4 0.175 mol·L-1 混合液中加入H2SO4使c(H+)增大,平衡向形成Ce3+水溶液方向移动。 Fe3+ + 3H2O ![]() Fe(OH)3(胶体) + 3H+
Fe(OH)3(胶体) + 3H+
【解析】
(1)先根据W的物质的量求出X的物质的量的变化量,根据v=![]() 计算v(X);利用速率之比等于化学计量数之比计算n的值;计算出2min内Y的浓度变化量,2min末时Y的浓度为Y的起始浓度减去2min内Y的浓度变化量;
计算v(X);利用速率之比等于化学计量数之比计算n的值;计算出2min内Y的浓度变化量,2min末时Y的浓度为Y的起始浓度减去2min内Y的浓度变化量;
(2)加入H2SO4获得较纯的含Ce3+的水溶液,氢离子浓度增大,平衡逆向移动;
(3)硫酸铁铵矾[Fe2(SO4)3(NH4)2SO424H2O]广泛用于水的净化处理,其净水原理是溶解后溶液中的铁离子水解生成氢氧化铁胶体,胶体具有吸附悬浮杂质的作用,可以净水。
(1)物质的量之比等于化学计量数之比,所以△n(X)=![]() △n(W)=
△n(W)=![]() ×0.3mol=0.2mol,2min内用X的浓度变化表示的平均反应速率v(X)=
×0.3mol=0.2mol,2min内用X的浓度变化表示的平均反应速率v(X)=![]() =
= =0.05mol(Lmin)-1;速率之比等于化学计量数之比,所以v(X):v(Z)=0.05mol(Lmin)-1:0.05mol(Lmin)-1=4:n,解得,n=4;物质的量之比等于化学计量数之比,所以△n(Y)=
=0.05mol(Lmin)-1;速率之比等于化学计量数之比,所以v(X):v(Z)=0.05mol(Lmin)-1:0.05mol(Lmin)-1=4:n,解得,n=4;物质的量之比等于化学计量数之比,所以△n(Y)=![]() △n(W)=
△n(W)=![]() ×0.3mol=0.25mol,所以2min内Y的浓度变化量△c(Y)=
×0.3mol=0.25mol,所以2min内Y的浓度变化量△c(Y)=![]() =
=![]() =0.125mol/L,Y的起始浓度为
=0.125mol/L,Y的起始浓度为![]() =0.3mol/L,则2min末时Y的浓度为0.3mol/L-0.125mol/L=0.175mol/L;
=0.3mol/L,则2min末时Y的浓度为0.3mol/L-0.125mol/L=0.175mol/L;
(2)向CeT3(有机层)加入H2SO4获得较纯的含Ce3+的水溶液的原因是混合液中加硫酸导致氢离子浓度增大,平衡向生成Ce3+水溶液方向移动;
(3)硫酸铁铵矾[Fe2(SO4)3(NH4)2SO424H2O]广泛用于水的净化处理,其净水原理是溶解后溶液中的铁离子水解生成氢氧化铁胶体,胶体具有吸附悬浮杂质的作用,可以净水,反应的离子方程式为:Fe3++3H2OFe(OH)3(胶体)+3H+。


科目:高中化学 来源: 题型:
【题目】反应2SO2 + O2 ![]() 2SO3是工业生产硫酸的关键步骤,下列说法不正确的
2SO3是工业生产硫酸的关键步骤,下列说法不正确的
A.实际生产中,此反应在接触室进行
B.过量空气能提高SO2的转化率
C.使用催化剂能提高该反应的反应速率
D.2molSO2与1molO2混合一定能生成2molSO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表前四周期的元素a、b、c、d、e,原子序数依次增大,a和b是组成物质种类最多的元素,c是地壳中含量最多的元素,d与b同族,e2+离子的3d轨道中有9个电子。回答下列问题:
(1)c、d两种元素形成的化合物统称硅石,可通过______________方法区分其结晶形和无定形的两种存在形态,c的价电子排布图为______________________________。
(2)A和B是生活中两种常见的有机物,A能与CaCO3反应,可用于厨房除水垢;B分子中的碳原子数目与A中相同,可与钠反应放出气体。B中存在的化学键类型是______;
A.离子键 B.共价键 C.金属键 D.氢键
A分子中碳原子的轨道杂化类型是___________。
(3)用“>”或“<”填空:
第一电离能 | 熔点 |
b___d | dc2晶体___d晶体 |
(4)c与e两种元素可形成一种半导体材料,化学式为e2c,在其立方晶胞内部有四个c原子,其余c原子位于面心和顶点,则该晶胞中有____个e原子。
(5)向e2+硫酸盐的水溶液中加入过量的氨水,可得到深蓝色透明溶液,写出生成配离子的结构______________(要求画出配位键)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下,由此可判断这四种金属的活动性顺序是( )
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小,b极质量增加 | b极有气体产生,c极无变化 | d极溶解,c极有气体产生 | 电流计指示,导线中电流从a极流向d极 |
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)砷(As)是一些工厂和矿山废水中的污染元素,使用吸附剂是去除水中砷的有效措施之一。将硫酸锰、硝酸钇与氢氧化钠溶液按一定比例混合,搅拌使其充分反应,可获得一种砷的高效吸附剂X,吸附剂X中含有![]() ,其原因是____________。
,其原因是____________。
(2)H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如题图1和题图2所示。
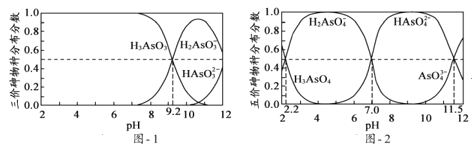
①以酚酞为指示剂(变色范围pH 8.0~10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为____。
②H3AsO4第一步电离方程式H3AsO4![]() H2AsO4+H+的电离常数为Ka1,则pKa1=____(pKa1=-lgKa1)。
H2AsO4+H+的电离常数为Ka1,则pKa1=____(pKa1=-lgKa1)。
(3)25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是______。
A.0.1mol/L CH3COONa溶液与0.1mol/L HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-)
B.含等物质的量的NaX和弱酸HX的混合溶液中一定存在:c(Na+)>c(X-)
C.0.1mol/L Na2CO3溶液与0.1mol/L NaHCO3溶液等体积混合:2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3)
D.Na2C2O4溶液与HCl溶液等体积混合(H2C2O4是二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)+c(Cl-)=c(Na+)+c(H+)
(4)下列图示与对应的叙述不相符的是______。
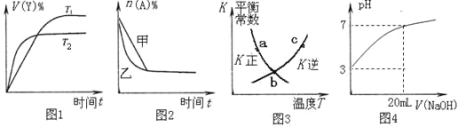
A.图1表示可逆反应“2X(g) ![]() Y(g)△H<0”温度T1<T2的情形
Y(g)△H<0”温度T1<T2的情形
B.图2表示压强对可逆反应2A(g)+2B(g) ![]() 3C(g)+D(s)的影响,乙压强比甲压强大
3C(g)+D(s)的影响,乙压强比甲压强大
C.图3中a、b、c三点中只有b点已经达到化学平衡状态
D.图4是向20 mL pH=3的醋酸溶液中滴加pH=11的NaOH溶液过程中pH变化曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海波![]() 是无色透明的晶体,易溶于水,遇酸立即分
是无色透明的晶体,易溶于水,遇酸立即分![]() ,硫化碱法是工业上制备海波的方法之一,反应原理为:
,硫化碱法是工业上制备海波的方法之一,反应原理为:![]() 某研究小组在实验室用硫化碱法制备
某研究小组在实验室用硫化碱法制备![]() ,实验装置如图所示:
,实验装置如图所示:

![]() 装置A中滴加浓硫酸的仪器名称是 ______ ,实验室还可以用A装置制取的气体单质的离子方程式是 ______ .
装置A中滴加浓硫酸的仪器名称是 ______ ,实验室还可以用A装置制取的气体单质的离子方程式是 ______ .
![]() 装置D的作用是检验装置C中
装置D的作用是检验装置C中![]() 的吸收效率,D中的试剂可以是 ______
的吸收效率,D中的试剂可以是 ______ ![]() 表明
表明![]() 吸收效率低的实验现象是 ______ .
吸收效率低的实验现象是 ______ .
![]() 实验制得的
实验制得的![]() 产品中可能含有
产品中可能含有![]() 、
、![]() 等杂质.请设计实验,检测
等杂质.请设计实验,检测![]() 产品中是否存在
产品中是否存在![]() 杂质,简要说明实验操作、现象和结论: ______ .
杂质,简要说明实验操作、现象和结论: ______ .
![]() 溶液是定量实验中的常用试剂,为了测定某
溶液是定量实验中的常用试剂,为了测定某![]() 溶液的浓度,研究小组的同学准确量取
溶液的浓度,研究小组的同学准确量取![]() 溶液于锥形瓶中,加入过量KI固体和适量的稀
溶液于锥形瓶中,加入过量KI固体和适量的稀![]() ,滴加指示剂,用
,滴加指示剂,用![]() 标准溶液滴定至终点,3次平行实验测得平均消耗
标准溶液滴定至终点,3次平行实验测得平均消耗![]() 溶液的体积为
溶液的体积为![]() ,则
,则![]() ______
______ ![]() 已知:
已知:![]() ,
,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,下列说法正确的是![]()
![]()
A.在滴有酚酞溶液的氨水里,加入![]() 至溶液恰好无色,则此时溶液的
至溶液恰好无色,则此时溶液的![]()
B.同![]() 的溶液:
的溶液:![]() 溶液,物质的量浓度最大的是
溶液,物质的量浓度最大的是![]()
C.有两种酸HA和HB,已知HA的酸性比HB弱,在物质的量浓度均为![]() 的NaA和NaB混合溶液中,有
的NaA和NaB混合溶液中,有![]()
D.pH相同的![]() 溶液、
溶液、![]() 溶液、
溶液、![]() 溶液、NaOH溶液,其浓度大小关系为:
溶液、NaOH溶液,其浓度大小关系为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向浓度相等、体积均为100 mL的A、B两份NaOH溶液中,分别通入一定量的CO2后,逐滴加入0.1 mol/L的盐酸,产生CO2的体积(标准状况)与所加盐酸的体积关系如图所示。

(1)A曲线表明,原溶液通入CO2 ________mL(标准状况)。
(2)B曲线表明,原溶液通入CO2后,所得溶液中溶质的物质的量之比为__________。
(3)原NaOH溶液的物质的量浓度为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用![]() 的盐酸滴定
的盐酸滴定![]() 溶液
溶液![]() 。用 pH传感器测得混合溶液的pH变化曲线如图,下列说法正确的是
。用 pH传感器测得混合溶液的pH变化曲线如图,下列说法正确的是
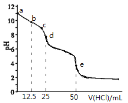
A.![]() 发生的主要离子反应:
发生的主要离子反应:![]()
B.在b点时,![]()
C.在d点时,![]()
D.在e点时![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com