
����Ŀ������![]() ����ɫ���ľ��壬������ˮ������������
����ɫ���ľ��壬������ˮ������������![]() ����ǹ�ҵ���Ʊ������ķ���֮һ����Ӧԭ��Ϊ��
����ǹ�ҵ���Ʊ������ķ���֮һ����Ӧԭ��Ϊ��![]() ij�о�С����ʵ��������Ʊ�
ij�о�С����ʵ��������Ʊ�![]() ��ʵ��װ����ͼ��ʾ��
��ʵ��װ����ͼ��ʾ��

![]() װ��A�еμ�Ũ��������������� ______ ��ʵ���һ�������Aװ����ȡ�����嵥�ʵ����ӷ���ʽ�� ______ ��
װ��A�еμ�Ũ��������������� ______ ��ʵ���һ�������Aװ����ȡ�����嵥�ʵ����ӷ���ʽ�� ______ ��
![]() װ��D�������Ǽ���װ��C��
װ��D�������Ǽ���װ��C��![]() ������Ч�ʣ�D�е��Լ������� ______
������Ч�ʣ�D�е��Լ������� ______ ![]() ����
����![]() ����Ч�ʵ͵�ʵ�������� ______ ��
����Ч�ʵ͵�ʵ�������� ______ ��
![]() ʵ���Ƶõ�
ʵ���Ƶõ�![]() ��Ʒ�п��ܺ���
��Ʒ�п��ܺ���![]() ��
��![]() �����ʣ������ʵ�飬���
�����ʣ������ʵ�飬���![]() ��Ʒ���Ƿ����
��Ʒ���Ƿ����![]() ���ʣ���Ҫ˵��ʵ�����������ͽ��ۣ� ______ ��
���ʣ���Ҫ˵��ʵ�����������ͽ��ۣ� ______ ��
![]() ��Һ�Ƕ���ʵ���еij����Լ���Ϊ�˲ⶨij
��Һ�Ƕ���ʵ���еij����Լ���Ϊ�˲ⶨij![]() ��Һ��Ũ�ȣ��о�С���ͬѧȷ��ȡ
��Һ��Ũ�ȣ��о�С���ͬѧȷ��ȡ![]() ��Һ����ƿ�У��������KI�����������ϡ
��Һ����ƿ�У��������KI�����������ϡ![]() ���μ�ָʾ������
���μ�ָʾ������![]() ����Һ�ζ����յ㣬3��ƽ��ʵ����ƽ������
����Һ�ζ����յ㣬3��ƽ��ʵ����ƽ������![]() ��Һ�����Ϊ
��Һ�����Ϊ![]() ����
����![]() ______
______ ![]() ��֪��
��֪��![]() ��
��![]()
���𰸡���Һ©��  Ʒ�졢��ˮ��
Ʒ�졢��ˮ��![]() ��Һ ��Һ��ɫ�ܿ���ɫ ȡ������Ʒ��������ϡ�����У����ã�ȡ�ϲ���Һ
��Һ ��Һ��ɫ�ܿ���ɫ ȡ������Ʒ��������ϡ�����У����ã�ȡ�ϲ���Һ![]() ����˺�ȡ��Һ
����˺�ȡ��Һ![]() ���μ�
���μ�![]() ��Һ�������ְ�ɫ������˵��
��Һ�������ְ�ɫ������˵��![]() �����к���
�������![]() ����
���� ![]()
��������
����Ʊ�![]() ��Aװ�ã��ڼ��������£�Cu��Ũ���ᷴӦ��������ͭ�����������ˮ���䷴Ӧ�ķ���ʽΪ��
��Aװ�ã��ڼ��������£�Cu��Ũ���ᷴӦ��������ͭ�����������ˮ���䷴Ӧ�ķ���ʽΪ��![]() Ũ
Ũ![]() ��Bװ�ã�����ƿ����ֹCҺ�嵹����Aװ�ã�Cװ�ã�Ϊ
��Bװ�ã�����ƿ����ֹCҺ�嵹����Aװ�ã�Cװ�ã�Ϊ![]() ������װ�ã�������ݿ���������������Һ�ĽӴ������ʹ���屻������գ����������ʵ���ȷ�ȣ�
������װ�ã�������ݿ���������������Һ�ĽӴ������ʹ���屻������գ����������ʵ���ȷ�ȣ�![]() ��Dװ�ã����������ܺ�Ʒ�����ã����������ܱ�������������������嵥�ʣ�������Һ����ɫ��ʢ��Ʒ�졢��ˮ��
��Dװ�ã����������ܺ�Ʒ�����ã����������ܱ�������������������嵥�ʣ�������Һ����ɫ��ʢ��Ʒ�졢��ˮ��![]() ��Һ���������Ǽ���װ��B��
��Һ���������Ǽ���װ��B��![]() ������Ч�ʣ�Eװ�ã����������ж�������ֱ���ŷŵ������У�β������װ�ã�����δ��Ӧ�Ķ�������
������Ч�ʣ�Eװ�ã����������ж�������ֱ���ŷŵ������У�β������װ�ã�����δ��Ӧ�Ķ�������
![]() ���������Ľṹ�ص��֪��װ��A�еμ�Ũ��������������Ƿ�Һ©����װ��AΪ�����������ȡ��
���������Ľṹ�ص��֪��װ��A�еμ�Ũ��������������Ƿ�Һ©����װ��AΪ�����������ȡ��![]() Ũ
Ũ![]() ����װ�����ڹ�Һ������װ�ã�ʵ���һ�������Aװ����ȡ������Ũ��������������ڼ��������·�Ӧ�Ʊ�
����װ�����ڹ�Һ������װ�ã�ʵ���һ�������Aװ����ȡ������Ũ��������������ڼ��������·�Ӧ�Ʊ�![]() �����ӷ���ʽΪ��
�����ӷ���ʽΪ��![]() ��
��
�ʴ�Ϊ����Һ©����![]() ��
��
![]() װ��D�������Ǽ���װ��C��
װ��D�������Ǽ���װ��C��![]() ������Ч�ʣ�˵��D�����������������Ӧ���������Ե��������������Ư���ԣ���ʹƷ����ɫ�����л�ԭ�ԣ��ܱ���ˮ��������ˮ��ɫ��
������Ч�ʣ�˵��D�����������������Ӧ���������Ե��������������Ư���ԣ���ʹƷ����ɫ�����л�ԭ�ԣ��ܱ���ˮ��������ˮ��ɫ��![]() ��������������������Һ����������ԭ��Ӧ����Ԫ�ػ��ϼ����ߣ�����������ֻ�ԭ�ԣ����������Һ��ɫ��
��������������������Һ����������ԭ��Ӧ����Ԫ�ػ��ϼ����ߣ�����������ֻ�ԭ�ԣ����������Һ��ɫ��![]() �����Կ�����Ʒ�졢��ˮ��
�����Կ�����Ʒ�졢��ˮ��![]() ��Һ����������������Ƿ���ȫƷ�����գ���C��
��Һ����������������Ƿ���ȫƷ�����գ���C��![]() ����Ч�ʵͣ���D�н���϶�Ķ���������D����Һ��ɫ�ܿ���ɫ��
����Ч�ʵͣ���D�н���϶�Ķ���������D����Һ��ɫ�ܿ���ɫ��
�ʴ�Ϊ��Ʒ�졢��ˮ��![]() ��Һ����Һ��ɫ�ܿ���ɫ��
��Һ����Һ��ɫ�ܿ���ɫ��
![]() ���
���![]() ��Ʒ���Ƿ����
��Ʒ���Ƿ����![]() ���ʣ��ȼӹ�����ϡ�����ų����ţ����ã�ȡ�ϲ���Һ���ټ��Ȼ����������ְ�ɫ������˵����Һ�к�����������ӣ���
���ʣ��ȼӹ�����ϡ�����ų����ţ����ã�ȡ�ϲ���Һ���ټ��Ȼ����������ְ�ɫ������˵����Һ�к�����������ӣ���![]() ��Ʒ�к���
��Ʒ�к���![]() ��
��
�ʴ�Ϊ��ȡ������Ʒ��������ϡ�����У����ã�ȡ�ϲ���Һ![]() ����˺�ȡ��Һ
����˺�ȡ��Һ![]() ���μ�
���μ�![]() ��Һ�������ְ�ɫ������˵��
��Һ�������ְ�ɫ������˵��![]() �����к���
�����к���![]() ���ʣ�
���ʣ�
![]() ��Һ����ƿ�У��������KI�����������ϡ
��Һ����ƿ�У��������KI�����������ϡ![]() ����Ӧ����
����Ӧ����![]() ����
����![]() ����Һ�ζ����յ㣬3��ƽ��ʵ����ƽ������
����Һ�ζ����յ㣬3��ƽ��ʵ����ƽ������![]() ��Һ�����Ϊ
��Һ�����Ϊ![]() ����
����![]() ��
��
��֪��![]() ��
��![]() ��
��
![]()
1mol 6mol
n![]()
��![]() ����
����![]() ��
��
�ʴ�Ϊ��![]() ��
��


 ���ſ����ϵ�д�
���ſ����ϵ�д� ���Ŀ����ϵ�д�
���Ŀ����ϵ�д� ������ӱ������ͯ������ϵ�д�
������ӱ������ͯ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��50 mL 0.50 mol��L1������50 mL 0.55 mol��L1 NaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȡ��ش��������⣺

��1����ʵ��װ���Ͽ���ͼ����ȱ�ٵ�һ�ֲ�����Ʒ��______________________________��
��2���ձ���������ֽ����������______________��
��3�����ձ����粻��Ӳֽ�壬��õ��к�����ֵ__________(����ƫ������ƫС��������Ӱ����)��
��4��ʵ���и���60 mL 0.50 mol��L1�����50 mL 0.55 mol��L1 NaOH��Һ���з�Ӧ��������ʵ����ȣ����ų�������__________(��������������������)�������к���__________(��������������������)���������ɣ�_________________________��
��5������ͬŨ�Ⱥ�����İ�ˮ����NaOH��Һ��������ʵ�飬��õ��к��ȵ���ֵ��__________(����ƫ������ƫС��������Ӱ��������ͬ)����50 mL 0.50 mol��L1 NaOH��Һ��������ʵ�飬��õ��к��ȵ���ֵ��__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ѿ����ҹ����ٵ��ش����⣮
��![]() ���ٶ�����̼���ŷ���һ����Ҫ���⣮�о�������
���ٶ�����̼���ŷ���һ����Ҫ���⣮�о�������![]() ��������ɺϳɵ�̼����
��������ɺϳɵ�̼����![]() ���ֻ�ѧ���ļ��������ʾ
���ֻ�ѧ���ļ��������ʾ
��ѧ�� |
|
|
|
|
|
|
���� | 803 | 436 | 332 | 409 | 463 | 326 |
ͨ������ó�![]() ______ ��
______ ��
![]() ��
��![]() �����ܱ�������Ͷ��
�����ܱ�������Ͷ��![]() ��
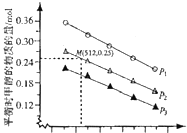
��![]() �����÷�Ӧ��ʵ���ò�ͬ�¶ȼ�ѹǿ�£�ƽ��ʱ���������ʵ�����ͼ��ʾ��
�����÷�Ӧ��ʵ���ò�ͬ�¶ȼ�ѹǿ�£�ƽ��ʱ���������ʵ�����ͼ��ʾ��
��ѹǿΪ![]() ���¶�Ϊ512Kʱ�����������Ͷ��
���¶�Ϊ512Kʱ�����������Ͷ��![]() ��
��![]()
![]() ��2mol
��2mol![]() ��
��![]()
![]() ʱ��ƽ���� ______ �����ƶ���
ʱ��ƽ���� ______ �����ƶ���
![]() ��
��![]() ������
������![]() ����
����![]() ��KOH��ҺΪԭ�ϣ���ʯīΪ�缫��ֱ�ӹ���ȼ�ϵ�أ���õ�صĸ�����ӦʽΪ ______ ���øõ�ص��
��KOH��ҺΪԭ�ϣ���ʯīΪ�缫��ֱ�ӹ���ȼ�ϵ�أ���õ�صĸ�����ӦʽΪ ______ ���øõ�ص��![]()
![]() ��Һ����ȼ�ϵ�����ı����56L����ʱ��������������������������������ʵ��� ______ ��
��Һ����ȼ�ϵ�����ı����56L����ʱ��������������������������������ʵ��� ______ ��
��![]() Ҳ��һ�ִ�����Ⱦ������ú�ˮ������
Ҳ��һ�ִ�����Ⱦ������ú�ˮ������![]() �ķ�������ˮ����Ҫ���ӵĺ������£�
�ķ�������ˮ����Ҫ���ӵĺ������£�
�ɷ� | ���� | �ɷ� | ���� |
| 18980 |
| 400 |
| 10560 |
| 142 |
| 2560 |
| 1272 |
![]() ��ˮ����������������
��ˮ����������������![]() ��
��![]() ��
��![]() ��
��![]() �������м���ʯ�ҽ�ʹ��ˮ�е�
�������м���ʯ�ҽ�ʹ��ˮ�е�![]() ת��Ϊ
ת��Ϊ![]() ����
����![]() �պó�����ȫʱ��
�պó�����ȫʱ��![]()
![]() Ϊ ______
Ϊ ______ ![]()
��֪![]()
![]()
![]() �������ķ�����
�������ķ�����![]() �ĺ�������ͨ�����������ⶨ���õ����Լ��У�
�ĺ�������ͨ�����������ⶨ���õ����Լ��У�![]() �ĵ����Һ��������Һ�����Ѵ�����ķ�����ÿ����
�ĵ����Һ��������Һ�����Ѵ�����ķ�����ÿ����![]() �����
�����![]() ������ͨ�뵽100mL���е��۵ĵ��Һ�У�tmin�ﵽ�ζ��յ㣮�ζ��յ������Ϊ ______ ����ô�������
������ͨ�뵽100mL���е��۵ĵ��Һ�У�tmin�ﵽ�ζ��յ㣮�ζ��յ������Ϊ ______ ����ô�������![]() �ĺ��� ______
�ĺ��� ______ ![]() �ú�a��t��ʽ�ӱ�ʾ
�ú�a��t��ʽ�ӱ�ʾ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
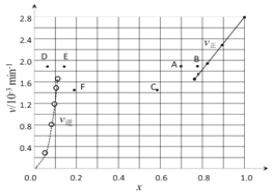
����Ŀ����һ����1���⼰�仯�����ںϳ�ɱ������ҩ��ȷ�����й㷺��;���ش��������⣺Bodensteins�о������з�Ӧ��2HI(g)![]() H2(g) + I2(g)����716Kʱ�����������е⻯������ʵ�������x(HI)�뷴Ӧʱ��t�Ĺ�ϵ���±���
H2(g) + I2(g)����716Kʱ�����������е⻯������ʵ�������x(HI)�뷴Ӧʱ��t�Ĺ�ϵ���±���
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
�ٸ�������ʵ�������÷�Ӧ��ƽ�ⳣ��K�ļ���ʽΪ��___________��
��������Ӧ�У�����Ӧ����Ϊv��= k����x2(HI)���淴Ӧ����Ϊv��=k����x(H2)��x(I2)������k����k��Ϊ���ʳ�������k��Ϊ________(��K��k����ʾ)����k��= 0.0027min-1����t=40minʱ��v��=________min-1��
��������ʵ�����ݼ���õ�v����x(HI)��v����x(H2)�Ĺ�ϵ������ͼ��ʾ�������ߵ�ijһ�¶�ʱ����Ӧ���´ﵽƽ�⣬��Ӧ�ĵ�ֱ�Ϊ_________________������ĸ����
�����������£���0.01 mol��L-1��Ba(OH)2��Һ200mL��0.01 mol��L-1��NaHSO4��Һ100mL��ϣ���Ӧ����Һ��pHֵΪ______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����0.4 mol X�����0.6 mol Y��������2 L�ܱ������У�ʹ���Ƿ������·�Ӧ��4 X(g)��5 Y(g) ![]() n Z(g)��6 W(g)��2 min ĩ������0.3 mol W������֪��Z��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ0.05 mol����L��min����1�����㣺ǰ2 min����X��Ũ�ȱ仯��ʾ��ƽ����Ӧ����________��ѧ��Ӧ����ʽ��n��ֵ��______________________��2 minĩʱY��Ũ��_____________________��
n Z(g)��6 W(g)��2 min ĩ������0.3 mol W������֪��Z��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ0.05 mol����L��min����1�����㣺ǰ2 min����X��Ũ�ȱ仯��ʾ��ƽ����Ӧ����________��ѧ��Ӧ����ʽ��n��ֵ��______________________��2 minĩʱY��Ũ��_____________________��
��2����֪�л��� HT �ܽ� Ce3+��ˮ��Һ����ȡ�������ù��̿ɱ�ʾΪ��2Ce3+ (ˮ��)+ 6HT���л��㣩![]() 2CeT3 (�л��㣩+ 6H+(ˮ��) ��ƽ��ǶȽ��ͣ��� CeT3 (�л��㣩���� H2SO4 ��ýϴ��ĺ� Ce3+��ˮ��Һ��ԭ����__________________________________��
2CeT3 (�л��㣩+ 6H+(ˮ��) ��ƽ��ǶȽ��ͣ��� CeT3 (�л��㣩���� H2SO4 ��ýϴ��ĺ� Ce3+��ˮ��Һ��ԭ����__________________________________��
��3��������立���Fe2(SO4) 3��(NH4) 2SO4��24H2O�ݹ㷺����ˮ�ľ����������侻ˮԭ�������ӷ���ʽ������______________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.��Ϊ SO2 ����Ư���ԣ���������ʹƷ����Һ����ˮ��KMnO4(H��)��ʯ����Һ��ɫ
B.�� 50 mL 18.4 mol/L H2SO4 ��Һ�м���������ͭƬ�����ȣ���ַ�Ӧ����ԭ�� H2SO4�����ʵ���С�� 0.46 mol
C.SO2��NO2 �� CO2 ���������������Ҫԭ������ˮ�� pH С�� 5.6
D.Ũ HNO3 ��Ũ���ᰴ 3��1 ������Ȼ�����õĻ�������ˮ�����ܽ��Ͳ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ε���Ҫ����Ϊ�������Ρ������(KIO3)�������軯��[K4Fe(CN)6��3H2O]�����������軯�ص���ˮ���ڸ����»ᷢ���ֽ⣺3K4[Fe(CN)6]![]() 2(CN)2��+12KCN+N2��+Fe3C+C����ش��������⣺
2(CN)2��+12KCN+N2��+Fe3C+C����ش��������⣺
��1���ٻ�̬Feԭ�Ӽ۵����Ų�ͼ�������ʾʽ��Ϊ_________________________
��C��N��O����Ԫ�صĵ�һ�����ܵĴ�С˳��Ϊ_____________��ԭ����__________��
��IO3-������ԭ�ӵ��ӻ���ʽΪ______��һ����CN-��Ϊ�ȵ�����ķ��ӵĵ���ʽΪ_______��
��1molFe(CN)63�к�����������ĿΪ____mol��
��2�������Fe(CO)x������ԭ�Ӽ۵������������ṩ������֮��Ϊ18����x��___��Fe(CO)x�����³�Һ̬���۵�Ϊ-20.5�棬�е�Ϊ103�棬�����ڷǼ����ܼ����ݴ˿��ж�Fe(CO)x��������__________(�������)��
��3����ͼ�Ǵ����������Ӿ���Fe3O4��ȡ�����������侧��ṹ��һ�������壬�������������������Ӵ���������Χ�ɵ�________(��ռ�ṹ)��϶��
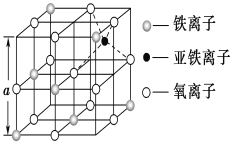
��4��Fe���γɶ������������FeO�����ṹΪNaCl�͡�������ʵ���ϴ��ڿ�λ����λ������ԭ�ӵ�ȱ�ݣ�����ȱ�ݶԾ�������ʻ�����ش�Ӱ�졣���ھ���ȱ�ݣ��ھ�����Fe��O�ĸ����ȷ����˱仯����ΪFexO��x��1���������ijFexO�����ܶ�Ϊ5.71gcm��3�������߳�Ϊ4.28��10��10 m����FexO��x=____�����ô���ʽ��ʾ����Ҫ���������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij![]() ��
��![]() �Ļ����Һ�м���������
�Ļ����Һ�м���������![]() �������Һ������Ũ�ȵĹ�ϵ��ͼ��ʾ������˵����ȷ����
�������Һ������Ũ�ȵĹ�ϵ��ͼ��ʾ������˵����ȷ����![]()
![]()
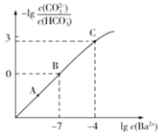
A.A��B��C�����Ӧ��ҺpH�Ĵ�С˳��Ϊ��![]()
B.B���Ӧ����Һ�д��ڣ�![]()
C.��C����Һ��ͨ��![]() ��ʹC����Һ��B����Һת��
��ʹC����Һ��B����Һת��
D.����Һ�д��ڣ�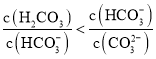
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б�����ȷ����
A. ������������C6H6Cl6�ķ�Ӧ��ȡ����Ӧ
B. ��ϩ����ˮ�����ӳɷ�Ӧ�IJ�����CH2CH2Br2
C. �����ʵ����ļ�����������Ӧ�IJ�����CH3Cl
D. ������������CH3CO18OCH2CH3ˮ�������Ҵ���������18O
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com