
【题目】深井岩盐的主要配料为:精制盐、碘酸钾(KIO3)、亚铁氰化钾[K4Fe(CN)6·3H2O]。其中亚铁氰化钾的无水盐在高温下会发生分解:3K4[Fe(CN)6]![]() 2(CN)2↑+12KCN+N2↑+Fe3C+C。请回答下列问题:
2(CN)2↑+12KCN+N2↑+Fe3C+C。请回答下列问题:
(1)①基态Fe原子价电子排布图(轨道表示式)为_________________________
②C、N和O三种元素的第一电离能的大小顺序为_____________,原因是__________。
③IO3-的中心原子的杂化方式为______。一种与CN-互为等电子体的分子的电子式为_______。
④1molFe(CN)63中含有σ键的数目为____mol。
(2)配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=___。Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于__________(填晶体类型)。
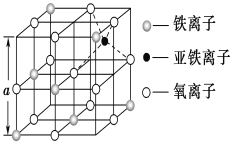
(3)如图是从铁氧体离子晶体Fe3O4中取出的能体现其晶体结构的一个立方体,该立方体中三价铁离子处于氧离子围成的________(填空间结构)空隙。
(4)Fe能形成多种氧化物,其中FeO晶胞结构为NaCl型。晶体中实际上存在空位、错位、杂质原子等缺陷,晶体缺陷对晶体的性质会产生重大影响。由于晶体缺陷,在晶体中Fe和O的个数比发生了变化,变为FexO(x<1),若测得某FexO晶体密度为5.71gcm﹣3,晶胞边长为4.28×10﹣10 m,则FexO中x=____。(用代数式表示,不要求算出具体结果)。
【答案】![]() N>O>C 同一周期中,第一电离能呈增大趋势,但N处于VA族,其最外层p能级处于半充满状态,第一电离能反常 sp3
N>O>C 同一周期中,第一电离能呈增大趋势,但N处于VA族,其最外层p能级处于半充满状态,第一电离能反常 sp3 ![]() 、
、![]() 12 5 分子晶体 正八面体
12 5 分子晶体 正八面体 ![]()
【解析】
根据核外电子排布规律书写价电子的轨道排布式;根据第一电离能的概念及全满、半满结构分析比较第一电离能的大小;根据价层电子对数判断中心原子的轨道杂化方式,根据等电子体概念判断等电子体;根据化学键的类型计算微粒中σ键的数目;根据晶胞的结构分析微粒间构成的空间构型,通过密度和体积进行相关计算;根据物质的物理性质分析判断晶体类型。
(1)①铁为26号元素,基态Fe原子核外电子排布式为[Ar]3d64s2,根据泡利不相容原理及洪特规则分析知价电子轨道表示式为:![]() ,故答案为:
,故答案为:![]() ;
;
②同一周期中,第一电离能呈增大趋势,但N处于VA族,其最外层p能级处于半充满状态,第一电离能反常,更稳定些,所以第一电离能更大些,故答案为:N>O>C;同一周期中,第一电离能呈增大趋势,但N处于VA族,其最外层p能级处于半充满状态,第一电离能反常;
③IO3-价层电子对数=![]() (O原子按不提供电子算),则根据价层电子对互斥理论分析,其中心原子的杂化方式为sp3;等电子体是原子总数相等,价电子总数相等的微粒,故与CN-互为等电子体的分子是CO或N2,它们的电子式为
(O原子按不提供电子算),则根据价层电子对互斥理论分析,其中心原子的杂化方式为sp3;等电子体是原子总数相等,价电子总数相等的微粒,故与CN-互为等电子体的分子是CO或N2,它们的电子式为![]() 、
、![]() ;故答案为:sp3;
;故答案为:sp3;![]() 、
、![]() ;
;
④C原子与N形成叁键,其中1个是σ键,2个是π键,CN-与铁离子之间有6个配位键,所以1molFe(CN)63中含有σ键的数目为12mol,故答案为:12;
(2)Fe原子价电子数为8,CO提供一对孤对电子,与Fe原子形成配位键,则8+2x=18,则x=5;配合物Fe(CO)x的熔沸点比较低,易溶于非极性溶剂,应属于分子晶体,故答案为:5;分子晶体;
(3)如图所示,氧离子处于三价铁离子的前后左右和上下,则构成的空间结构为正八面体,故答案为:正八面体;
(4)FexO晶胞结构为NaCl型,所以每个晶胞中含有4个O原子,有4个“FexO”,再根据m=ρV可知:![]() ,则x=
,则x=![]() ,故答案为:
,故答案为:![]() 。
。


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的溶液,下列说法正确的是
A.容量瓶未干燥即用来配置溶液导致配置溶液浓度偏低
B.把4.0gCuSO4溶于250mL蒸馏水中配置250mL0.1mol/LCuSO4溶液
C.转移溶液没有用蒸馏水洗涤烧杯,直接用蒸馏水定容,导致配制溶液浓度偏低
D.称取硫酸铜晶体45g,配置90mL 2mol/L的硫酸铜溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下,由此可判断这四种金属的活动性顺序是( )
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小,b极质量增加 | b极有气体产生,c极无变化 | d极溶解,c极有气体产生 | 电流计指示,导线中电流从a极流向d极 |
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海波![]() 是无色透明的晶体,易溶于水,遇酸立即分
是无色透明的晶体,易溶于水,遇酸立即分![]() ,硫化碱法是工业上制备海波的方法之一,反应原理为:
,硫化碱法是工业上制备海波的方法之一,反应原理为:![]() 某研究小组在实验室用硫化碱法制备
某研究小组在实验室用硫化碱法制备![]() ,实验装置如图所示:
,实验装置如图所示:

![]() 装置A中滴加浓硫酸的仪器名称是 ______ ,实验室还可以用A装置制取的气体单质的离子方程式是 ______ .
装置A中滴加浓硫酸的仪器名称是 ______ ,实验室还可以用A装置制取的气体单质的离子方程式是 ______ .
![]() 装置D的作用是检验装置C中
装置D的作用是检验装置C中![]() 的吸收效率,D中的试剂可以是 ______
的吸收效率,D中的试剂可以是 ______ ![]() 表明
表明![]() 吸收效率低的实验现象是 ______ .
吸收效率低的实验现象是 ______ .
![]() 实验制得的
实验制得的![]() 产品中可能含有
产品中可能含有![]() 、
、![]() 等杂质.请设计实验,检测
等杂质.请设计实验,检测![]() 产品中是否存在
产品中是否存在![]() 杂质,简要说明实验操作、现象和结论: ______ .
杂质,简要说明实验操作、现象和结论: ______ .
![]() 溶液是定量实验中的常用试剂,为了测定某
溶液是定量实验中的常用试剂,为了测定某![]() 溶液的浓度,研究小组的同学准确量取
溶液的浓度,研究小组的同学准确量取![]() 溶液于锥形瓶中,加入过量KI固体和适量的稀
溶液于锥形瓶中,加入过量KI固体和适量的稀![]() ,滴加指示剂,用
,滴加指示剂,用![]() 标准溶液滴定至终点,3次平行实验测得平均消耗
标准溶液滴定至终点,3次平行实验测得平均消耗![]() 溶液的体积为
溶液的体积为![]() ,则
,则![]() ______
______ ![]() 已知:
已知:![]() ,
,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,下列说法正确的是![]()
![]()
A.在滴有酚酞溶液的氨水里,加入![]() 至溶液恰好无色,则此时溶液的
至溶液恰好无色,则此时溶液的![]()
B.同![]() 的溶液:
的溶液:![]() 溶液,物质的量浓度最大的是
溶液,物质的量浓度最大的是![]()
C.有两种酸HA和HB,已知HA的酸性比HB弱,在物质的量浓度均为![]() 的NaA和NaB混合溶液中,有
的NaA和NaB混合溶液中,有![]()
D.pH相同的![]() 溶液、
溶液、![]() 溶液、
溶液、![]() 溶液、NaOH溶液,其浓度大小关系为:
溶液、NaOH溶液,其浓度大小关系为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系图中,A 是一种正盐,B 是气态氢化物,C 是单质,F 是强酸。当 X 无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去),当 X 是强碱时,过量的 B 跟 Cl2 反应除生成 C 外,另一产物是盐酸盐。
下列说法中不正确的是( )
![]()
A.当 X 是强酸时,A、B、C、D、E、F中均含同一种元素,F 可能是 H2SO4
B.当 X 是强碱时,A、B、C、D、E、F中均含同一种元素,F 是 HNO3
C.用 O2 代替 Cl2, 也能与 B 反应生成 C 物质
D.当 X 是强酸时,C 在常温下是一种易溶于酒精的固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向浓度相等、体积均为100 mL的A、B两份NaOH溶液中,分别通入一定量的CO2后,逐滴加入0.1 mol/L的盐酸,产生CO2的体积(标准状况)与所加盐酸的体积关系如图所示。

(1)A曲线表明,原溶液通入CO2 ________mL(标准状况)。
(2)B曲线表明,原溶液通入CO2后,所得溶液中溶质的物质的量之比为__________。
(3)原NaOH溶液的物质的量浓度为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质一定属于同系物的( )
①![]() ②
②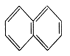 ③
③![]() ④C2H4 ⑤CH2=CH-CH=CH2 ⑥C3H6 ⑦
④C2H4 ⑤CH2=CH-CH=CH2 ⑥C3H6 ⑦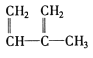 ⑧
⑧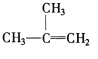
A.④和⑥B.①、②和③C.⑤和⑦D.④⑥和⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国制碱工业的先驱——侯德榜先生发明了著名的侯氏制碱法,其核心反应原理可用如下化学方程式表示:NH3+CO2+NaCl+H2O→NH4Cl+NaHCO3(晶体)。依据此原理,欲制得碳酸氢钠晶体,某校学生设计了如下实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和。

(1)A装置中所发生反应的离子方程式为___。C装置中稀硫酸的作用为___。
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100g水)
温度 溶解度 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
参照表中数据,请分析B装置中使用冰水的目的是___。
(3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在___装置与___装置之间(填写字母)连接一个盛有___的洗气装置,其作用是___。
(4)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.04g,则NaHCO3的产率为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com