
【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下,由此可判断这四种金属的活动性顺序是( )
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小,b极质量增加 | b极有气体产生,c极无变化 | d极溶解,c极有气体产生 | 电流计指示,导线中电流从a极流向d极 |
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
①可以用Cu(OH)2悬浊液用一种试剂鉴别甲酸、乙酸、乙醛、乙醇。
②可用酸性K2Cr2O7溶液检验是否酒后驾车,该应用利用了乙醇的还原性和低沸点的性质。
③向银氨溶液中加入几滴乙醛后用酒精灯加热至沸腾制可得银镜。
④向足量的浓苯酚溶液中滴入少量溴水,可观察到有白色沉淀生成,该沉淀为2,4,6-三溴苯酚。
⑤该分子 中的碳原子可能都在同一平面。
中的碳原子可能都在同一平面。
⑥做过银镜反应实验后的试管,用氨水洗涤。
A. ①②④⑤⑥ B. ①②③④ C. ①②④ D. ①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用某浓度NaOH溶液滴定一元酸HA的滴定曲线如图所示(横坐标为滴入NaOH的体积,纵坐标为所得混合液的pH;甲基橙变色范围为3.1~4.4)。下列判断正确的是
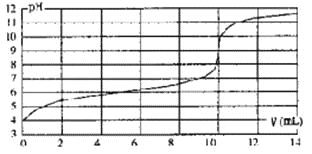
A.HA的浓度为l×10-4mol·L-1
B.实验时可选甲基橙作指示剂
C.V=10mL,酸碱恰好中和
D.pH=7时,溶液中c(Na+)>c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境问题已经是我国面临的重大问题.
Ⅰ![]() 减少二氧化碳的排放是一项重要课题.研究表明,
减少二氧化碳的排放是一项重要课题.研究表明,![]() 经催化加氢可合成低碳醇:
经催化加氢可合成低碳醇:![]() 几种化学键的键能如表所示
几种化学键的键能如表所示
化学键 |
|
|
|
|
|
|
键能 | 803 | 436 | 332 | 409 | 463 | 326 |
通过计算得出![]() ______ .
______ .
![]() 在
在![]() 恒容密闭容器中投入
恒容密闭容器中投入![]() 和
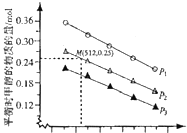
和![]() 发生该反应,实验测得不同温度及压强下,平衡时甲醉的物质的量如图所示.
发生该反应,实验测得不同温度及压强下,平衡时甲醉的物质的量如图所示.
当压强为![]() ,温度为512K时,向该容器中投入
,温度为512K时,向该容器中投入![]() 、
、![]()
![]() 、2mol
、2mol![]() 、
、![]()
![]() 时,平衡向 ______ 方向移动.
时,平衡向 ______ 方向移动.
![]() 以
以![]() 、空气
、空气![]() 含量
含量![]() 、KOH溶液为原料,以石墨为电极可直接构成燃料电池,则该电池的负极反应式为 ______ ;用该电池电解
、KOH溶液为原料,以石墨为电极可直接构成燃料电池,则该电池的负极反应式为 ______ ;用该电池电解![]()
![]() 溶液,当燃料电池消耗标况下56L空气时,计算理论上两极电解产生气体的总物质的量 ______ .
溶液,当燃料电池消耗标况下56L空气时,计算理论上两极电解产生气体的总物质的量 ______ .
Ⅱ![]() 也是一种大气污染物,可以用海水处理含
也是一种大气污染物,可以用海水处理含![]() 的废气,海水中主要离子的含量如下:
的废气,海水中主要离子的含量如下:
成分 | 含量 | 成分 | 含量 |
| 18980 |
| 400 |
| 10560 |
| 142 |
| 2560 |
| 1272 |
![]() 海水经初步处理后,还含有
海水经初步处理后,还含有![]() 、
、![]() ,
,![]() 、
、![]() ,向其中加入石灰浆使海水中的
,向其中加入石灰浆使海水中的![]() 转换为
转换为![]() ,当
,当![]() 刚好沉淀完全时,
刚好沉淀完全时,![]()
![]() 为 ______
为 ______ ![]()
已知![]()
![]()
![]() 处理过的废气中
处理过的废气中![]() 的含量可以通过碘量法来测定.用到的试剂有:
的含量可以通过碘量法来测定.用到的试剂有:![]() 的碘标准溶液,淀粉溶液.当把处理后的废气以每分钟
的碘标准溶液,淀粉溶液.当把处理后的废气以每分钟![]() 标况下
标况下![]() 的流速通入到100mL含有淀粉的碘标准液中,tmin达到滴定终点.滴定终点的现象为 ______ 计算该处理气中
的流速通入到100mL含有淀粉的碘标准液中,tmin达到滴定终点.滴定终点的现象为 ______ 计算该处理气中![]() 的含量 ______
的含量 ______ ![]() 用含a,t的式子表示
用含a,t的式子表示![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若往![]() 的弱酸
的弱酸![]() 溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法正确的是______
溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法正确的是______![]() 填序号
填序号![]() 。
。
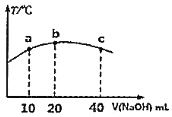
![]() 该烧碱溶液的浓度为
该烧碱溶液的浓度为![]()
![]() 该烧碱溶液的浓度为
该烧碱溶液的浓度为![]()
![]() 的电离平衡常数:b点
的电离平衡常数:b点![]() 点
点
![]() 从b点到c点,混合溶液中一直存在:
从b点到c点,混合溶液中一直存在:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)(1)碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:Bodensteins研究了下列反应:2HI(g)![]() H2(g) + I2(g)。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
H2(g) + I2(g)。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为:___________。
②上述反应中,正反应速率为v正= k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数,则k正为________(以K和k逆表示)。若k正= 0.0027min-1,在t=40min时,v正=________min-1。
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为_________________(填字母)。
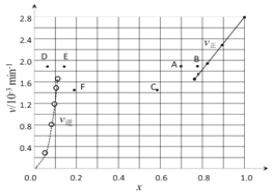
(二)常温下,将0.01 mol·L-1的Ba(OH)2溶液200mL和0.01 mol·L-1的NaHSO4溶液100mL混合,反应后溶液的pH值为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)把0.4 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:4 X(g)+5 Y(g) ![]() n Z(g)+6 W(g)。2 min 末已生成0.3 mol W,若测知以Z的浓度变化表示的反应速率为0.05 mol·(L·min)-1,计算:前2 min内用X的浓度变化表示的平均反应速率________化学反应方程式中n的值是______________________,2 min末时Y的浓度_____________________。
n Z(g)+6 W(g)。2 min 末已生成0.3 mol W,若测知以Z的浓度变化表示的反应速率为0.05 mol·(L·min)-1,计算:前2 min内用X的浓度变化表示的平均反应速率________化学反应方程式中n的值是______________________,2 min末时Y的浓度_____________________。
(2)已知有机物 HT 能将 Ce3+从水溶液中萃取出来,该过程可表示为:2Ce3+ (水层)+ 6HT(有机层)![]() 2CeT3 (有机层)+ 6H+(水层) 从平衡角度解释:向 CeT3 (有机层)加入 H2SO4 获得较纯的含 Ce3+的水溶液的原因是__________________________________。
2CeT3 (有机层)+ 6H+(水层) 从平衡角度解释:向 CeT3 (有机层)加入 H2SO4 获得较纯的含 Ce3+的水溶液的原因是__________________________________。
(3)硫酸铁铵矾[Fe2(SO4) 3·(NH4) 2SO4·24H2O]广泛用于水的净化处理,其净水原理用离子方程式解释是______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】深井岩盐的主要配料为:精制盐、碘酸钾(KIO3)、亚铁氰化钾[K4Fe(CN)6·3H2O]。其中亚铁氰化钾的无水盐在高温下会发生分解:3K4[Fe(CN)6]![]() 2(CN)2↑+12KCN+N2↑+Fe3C+C。请回答下列问题:
2(CN)2↑+12KCN+N2↑+Fe3C+C。请回答下列问题:
(1)①基态Fe原子价电子排布图(轨道表示式)为_________________________
②C、N和O三种元素的第一电离能的大小顺序为_____________,原因是__________。
③IO3-的中心原子的杂化方式为______。一种与CN-互为等电子体的分子的电子式为_______。
④1molFe(CN)63中含有σ键的数目为____mol。
(2)配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=___。Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于__________(填晶体类型)。
(3)如图是从铁氧体离子晶体Fe3O4中取出的能体现其晶体结构的一个立方体,该立方体中三价铁离子处于氧离子围成的________(填空间结构)空隙。
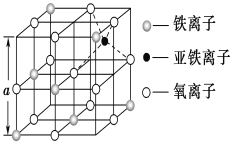
(4)Fe能形成多种氧化物,其中FeO晶胞结构为NaCl型。晶体中实际上存在空位、错位、杂质原子等缺陷,晶体缺陷对晶体的性质会产生重大影响。由于晶体缺陷,在晶体中Fe和O的个数比发生了变化,变为FexO(x<1),若测得某FexO晶体密度为5.71gcm﹣3,晶胞边长为4.28×10﹣10 m,则FexO中x=____。(用代数式表示,不要求算出具体结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是( )
A. 甲烷的燃烧热为 890.3 kJ/mol,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ/mol
B. 500℃、30MPa 下,将 0.5mol N2和 1.5molH2置于密闭容器中充分反应生成 NH3(g),放热 19.3 kJ,其热化学方程式为:N2(g)+3H2(g) ![]() 2NH3(g) △H = -38.6 kJ/mol
2NH3(g) △H = -38.6 kJ/mol
C. 稀盐酸和 稀氢氧化钠溶液混合, 其热化学方程式为:H+(aq)+OH-(aq)=H2O(1) △H = -57.3 kJ/mol
D. 1molH2完全燃烧放热 142.9kJ,则氢气燃烧的热化学方程式为: 2H2(g)+O2(g)=2H2O(1)△H =+285.8 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com