
【题目】若往![]() 的弱酸
的弱酸![]() 溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法正确的是______
溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法正确的是______![]() 填序号
填序号![]() 。
。
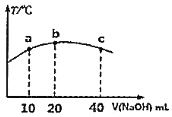
![]() 该烧碱溶液的浓度为
该烧碱溶液的浓度为![]()
![]() 该烧碱溶液的浓度为
该烧碱溶液的浓度为![]()
![]() 的电离平衡常数:b点
的电离平衡常数:b点![]() 点
点
![]() 从b点到c点,混合溶液中一直存在:
从b点到c点,混合溶液中一直存在:![]()
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】常温下,用![]() 溶液,分别滴定
溶液,分别滴定![]() 浓度均为
浓度均为![]() 溶液和HCN溶液,所得滴定曲线如图。下列说法正确的是
溶液和HCN溶液,所得滴定曲线如图。下列说法正确的是![]()

A.点![]() 和点
和点![]() 所示溶液中:
所示溶液中:![]()
B.醋酸的滴定终点是![]()
C.滴定![]() 过程中不可能出现:
过程中不可能出现:![]()
D.滴定HCN过程中可以用酚酞试液指示终点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰水杨酸即阿司匹林是最常用的解热镇痛药,其结构如图所示。关于它的描述中不正确的是( )
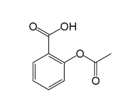
A.分子式为C9H8O4
B.其在酸性条件下水解产物遇氯化铁溶液可以呈现紫色
C.1mol 乙酰水杨酸最多可以与3molH2 反应
D.1mol 乙酰水杨酸最多可以与2molNaOH 反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表前四周期的元素a、b、c、d、e,原子序数依次增大,a和b是组成物质种类最多的元素,c是地壳中含量最多的元素,d与b同族,e2+离子的3d轨道中有9个电子。回答下列问题:
(1)c、d两种元素形成的化合物统称硅石,可通过______________方法区分其结晶形和无定形的两种存在形态,c的价电子排布图为______________________________。
(2)A和B是生活中两种常见的有机物,A能与CaCO3反应,可用于厨房除水垢;B分子中的碳原子数目与A中相同,可与钠反应放出气体。B中存在的化学键类型是______;
A.离子键 B.共价键 C.金属键 D.氢键
A分子中碳原子的轨道杂化类型是___________。
(3)用“>”或“<”填空:
第一电离能 | 熔点 |
b___d | dc2晶体___d晶体 |
(4)c与e两种元素可形成一种半导体材料,化学式为e2c,在其立方晶胞内部有四个c原子,其余c原子位于面心和顶点,则该晶胞中有____个e原子。
(5)向e2+硫酸盐的水溶液中加入过量的氨水,可得到深蓝色透明溶液,写出生成配离子的结构______________(要求画出配位键)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,两相邻圆圈内物质间含有相同的某一原子,且该原子的物质的量相同(设NA为阿伏加德罗常数的值)。
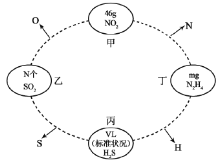
回答下列问题:
(1)乙中的N为___________,丙中的V为___________。
(2)甲中NO2和丁中N2H4的物质的量之比为___________。
(3)乙中SO2和丁中N2H4的质量之比为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下,由此可判断这四种金属的活动性顺序是( )
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小,b极质量增加 | b极有气体产生,c极无变化 | d极溶解,c极有气体产生 | 电流计指示,导线中电流从a极流向d极 |
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)砷(As)是一些工厂和矿山废水中的污染元素,使用吸附剂是去除水中砷的有效措施之一。将硫酸锰、硝酸钇与氢氧化钠溶液按一定比例混合,搅拌使其充分反应,可获得一种砷的高效吸附剂X,吸附剂X中含有![]() ,其原因是____________。
,其原因是____________。
(2)H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如题图1和题图2所示。
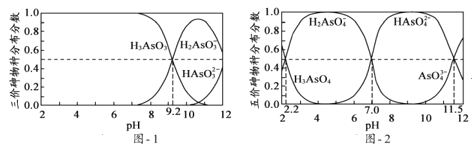
①以酚酞为指示剂(变色范围pH 8.0~10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为____。
②H3AsO4第一步电离方程式H3AsO4![]() H2AsO4+H+的电离常数为Ka1,则pKa1=____(pKa1=-lgKa1)。
H2AsO4+H+的电离常数为Ka1,则pKa1=____(pKa1=-lgKa1)。
(3)25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是______。
A.0.1mol/L CH3COONa溶液与0.1mol/L HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-)
B.含等物质的量的NaX和弱酸HX的混合溶液中一定存在:c(Na+)>c(X-)
C.0.1mol/L Na2CO3溶液与0.1mol/L NaHCO3溶液等体积混合:2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3)
D.Na2C2O4溶液与HCl溶液等体积混合(H2C2O4是二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)+c(Cl-)=c(Na+)+c(H+)
(4)下列图示与对应的叙述不相符的是______。
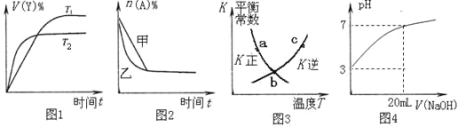
A.图1表示可逆反应“2X(g) ![]() Y(g)△H<0”温度T1<T2的情形
Y(g)△H<0”温度T1<T2的情形
B.图2表示压强对可逆反应2A(g)+2B(g) ![]() 3C(g)+D(s)的影响,乙压强比甲压强大
3C(g)+D(s)的影响,乙压强比甲压强大
C.图3中a、b、c三点中只有b点已经达到化学平衡状态
D.图4是向20 mL pH=3的醋酸溶液中滴加pH=11的NaOH溶液过程中pH变化曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,下列说法正确的是![]()
![]()
A.在滴有酚酞溶液的氨水里,加入![]() 至溶液恰好无色,则此时溶液的
至溶液恰好无色,则此时溶液的![]()
B.同![]() 的溶液:
的溶液:![]() 溶液,物质的量浓度最大的是
溶液,物质的量浓度最大的是![]()
C.有两种酸HA和HB,已知HA的酸性比HB弱,在物质的量浓度均为![]() 的NaA和NaB混合溶液中,有
的NaA和NaB混合溶液中,有![]()
D.pH相同的![]() 溶液、
溶液、![]() 溶液、
溶液、![]() 溶液、NaOH溶液,其浓度大小关系为:
溶液、NaOH溶液,其浓度大小关系为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写出下列物质的结构简式:
(1)2,4-二氯甲苯的结构简式为____;
(2)反-2-戊烯的结构简式为___;
(3)分子式为C6H12的某烯烃与氢气加成后得到的烷烃分子中含4个甲基,且该烯烃不存在顺反异构体,则该烯烃的一种结构简式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com