
【题目】在室温下,下列说法正确的是![]()
![]()
A.在滴有酚酞溶液的氨水里,加入![]() 至溶液恰好无色,则此时溶液的
至溶液恰好无色,则此时溶液的![]()
B.同![]() 的溶液:
的溶液:![]() 溶液,物质的量浓度最大的是
溶液,物质的量浓度最大的是![]()
C.有两种酸HA和HB,已知HA的酸性比HB弱,在物质的量浓度均为![]() 的NaA和NaB混合溶液中,有
的NaA和NaB混合溶液中,有![]()
D.pH相同的![]() 溶液、
溶液、![]() 溶液、
溶液、![]() 溶液、NaOH溶液,其浓度大小关系为:
溶液、NaOH溶液,其浓度大小关系为:![]()
【答案】B
【解析】
A.酚酞的变色范围是8~10,所以在滴有酚酞溶液的氨水里,加入![]() 至溶液恰好无色,说明此时溶液的pH<8,A错误;
至溶液恰好无色,说明此时溶液的pH<8,A错误;
B.![]() 和
和![]() 相互抑制水解,
相互抑制水解,![]() 促进
促进![]() 水解,氯离子对
水解,氯离子对![]() 水解无影响,一水合氨是弱碱,在溶液中存在微弱的电离平衡,
水解无影响,一水合氨是弱碱,在溶液中存在微弱的电离平衡,![]() 是强电解质,在水溶液中完全电离,
是强电解质,在水溶液中完全电离,![]() 是弱电解质,在水溶液中部分电离,相同浓度的这几种溶液中一水合氨中
是弱电解质,在水溶液中部分电离,相同浓度的这几种溶液中一水合氨中![]() 最小,所以同
最小,所以同![]() 的溶液:
的溶液:![]() 溶液,物质的量浓度最大的是
溶液,物质的量浓度最大的是![]() ,B正确;
,B正确;
C.HA的酸性比HB弱,则相同浓度的HB的电离程度大于HA,酸的电离程度越大,其酸根离子的水解能力越小,所以![]() 的水解能力大于
的水解能力大于![]() ,c(B-)>c(A-),c(HA)>c(HB);OH-又因A-、B-水解产生和水电离产生,则c(OH-)>c(HA),所以在物质的量浓度均为0.1mol/L的NaA和NaB混合溶液中微粒浓度大小顺序为:c(Na+)>c(B-)>c(A-)> c(OH-)>c(HA)>c(HB)>c(H+) ,C错误;
,c(B-)>c(A-),c(HA)>c(HB);OH-又因A-、B-水解产生和水电离产生,则c(OH-)>c(HA),所以在物质的量浓度均为0.1mol/L的NaA和NaB混合溶液中微粒浓度大小顺序为:c(Na+)>c(B-)>c(A-)> c(OH-)>c(HA)>c(HB)>c(H+) ,C错误;
D.pH相同的![]() 溶液、
溶液、![]() 溶液、
溶液、![]() 溶液、NaOH溶液中,c(OH-):碱电离大于盐的水解,且形成盐的酸的酸性越弱,盐水解程度越大,当溶液pH相等时,盐的浓度越小。氢氧化钠溶液为强碱,其浓度最小;酸性:CH3COOH>C6H5OH>NaHCO3,水解程度碳酸钠最大、醋酸钠最小,则pH相同时盐的浓度大小为:
溶液、NaOH溶液中,c(OH-):碱电离大于盐的水解,且形成盐的酸的酸性越弱,盐水解程度越大,当溶液pH相等时,盐的浓度越小。氢氧化钠溶液为强碱,其浓度最小;酸性:CH3COOH>C6H5OH>NaHCO3,水解程度碳酸钠最大、醋酸钠最小,则pH相同时盐的浓度大小为:![]() ,所以四种物质的浓度关系为:
,所以四种物质的浓度关系为:![]() ,D错误;
,D错误;
故合理选项是B。


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】中和滴定实验是中学化学的重要实验之一。下列有关说法错误的是![]() 滴定过程的其他操作均正确
滴定过程的其他操作均正确![]()
A.滴定管洗净后,应用待装液润洗![]() 次
次
B.用![]() 酸式滴定管量取
酸式滴定管量取![]()
![]() 溶液
溶液
C.滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁
D.滴定前滴定管内无气泡,终点读数时有气泡,所滴加液体体积偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若往![]() 的弱酸
的弱酸![]() 溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法正确的是______
溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法正确的是______![]() 填序号
填序号![]() 。
。
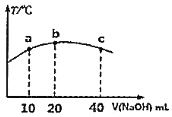
![]() 该烧碱溶液的浓度为
该烧碱溶液的浓度为![]()
![]() 该烧碱溶液的浓度为
该烧碱溶液的浓度为![]()
![]() 的电离平衡常数:b点
的电离平衡常数:b点![]() 点
点
![]() 从b点到c点,混合溶液中一直存在:
从b点到c点,混合溶液中一直存在:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)把0.4 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:4 X(g)+5 Y(g) ![]() n Z(g)+6 W(g)。2 min 末已生成0.3 mol W,若测知以Z的浓度变化表示的反应速率为0.05 mol·(L·min)-1,计算:前2 min内用X的浓度变化表示的平均反应速率________化学反应方程式中n的值是______________________,2 min末时Y的浓度_____________________。
n Z(g)+6 W(g)。2 min 末已生成0.3 mol W,若测知以Z的浓度变化表示的反应速率为0.05 mol·(L·min)-1,计算:前2 min内用X的浓度变化表示的平均反应速率________化学反应方程式中n的值是______________________,2 min末时Y的浓度_____________________。
(2)已知有机物 HT 能将 Ce3+从水溶液中萃取出来,该过程可表示为:2Ce3+ (水层)+ 6HT(有机层)![]() 2CeT3 (有机层)+ 6H+(水层) 从平衡角度解释:向 CeT3 (有机层)加入 H2SO4 获得较纯的含 Ce3+的水溶液的原因是__________________________________。
2CeT3 (有机层)+ 6H+(水层) 从平衡角度解释:向 CeT3 (有机层)加入 H2SO4 获得较纯的含 Ce3+的水溶液的原因是__________________________________。
(3)硫酸铁铵矾[Fe2(SO4) 3·(NH4) 2SO4·24H2O]广泛用于水的净化处理,其净水原理用离子方程式解释是______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是工业制纯碱的部分物质转化示意图,下列说法错误的是
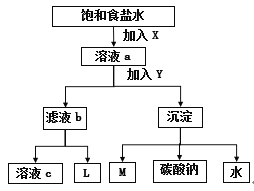
A. X是NH3,Y是CO2
B. M可在转化流程中循环利用
C. 若是联合制碱法,则L的主要成分是NH4Cl
D. 若是氨碱法,溶液c可在转化流程中循环利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】深井岩盐的主要配料为:精制盐、碘酸钾(KIO3)、亚铁氰化钾[K4Fe(CN)6·3H2O]。其中亚铁氰化钾的无水盐在高温下会发生分解:3K4[Fe(CN)6]![]() 2(CN)2↑+12KCN+N2↑+Fe3C+C。请回答下列问题:
2(CN)2↑+12KCN+N2↑+Fe3C+C。请回答下列问题:
(1)①基态Fe原子价电子排布图(轨道表示式)为_________________________
②C、N和O三种元素的第一电离能的大小顺序为_____________,原因是__________。
③IO3-的中心原子的杂化方式为______。一种与CN-互为等电子体的分子的电子式为_______。
④1molFe(CN)63中含有σ键的数目为____mol。
(2)配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=___。Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于__________(填晶体类型)。
(3)如图是从铁氧体离子晶体Fe3O4中取出的能体现其晶体结构的一个立方体,该立方体中三价铁离子处于氧离子围成的________(填空间结构)空隙。
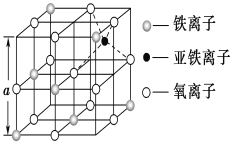
(4)Fe能形成多种氧化物,其中FeO晶胞结构为NaCl型。晶体中实际上存在空位、错位、杂质原子等缺陷,晶体缺陷对晶体的性质会产生重大影响。由于晶体缺陷,在晶体中Fe和O的个数比发生了变化,变为FexO(x<1),若测得某FexO晶体密度为5.71gcm﹣3,晶胞边长为4.28×10﹣10 m,则FexO中x=____。(用代数式表示,不要求算出具体结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氧磷(POCl3)是重要的基础化工原料,广泛用于制药、染化、塑胶助剂等行业。某兴趣小组模拟PCl3直接氧化法制备POCl3,实验装置设计如下:
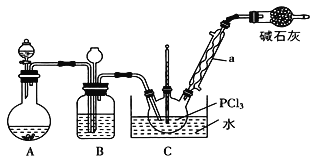
有关物质的部分性质如下表:
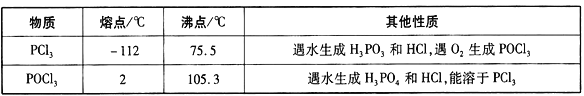
回答下列问题:
(1)仪器a的名称是_____________。装置A中发生反应的化学方程式为_______。
(2)装置C中制备POCl3的化学方程式为________________________________。
(3)C装置控制反应在60~65℃进行,其主要目的是_______________________。
(4)通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
I.取xg产品于锥形瓶中,加入足量NaOH溶液,待完全反应后加稀硝酸至溶液显酸性;
II.向锥形瓶中加入0.1000 mol·L-1的AgNO3溶液40.00 mL,使Cl-完全沉淀;
III.向其中加入2 mL硝基苯,用力摇动,使沉淀表面被有机物覆盖;
IV.加入指示剂,用c mol·L-1 NH4SCN溶液滴定过量Ag+至终点,记下所用体积为VmL。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12
①滴定选用的指示剂是(填序号)________,滴定终点的现象为_____________。
a.酚酞 b.NH4Fe(SO4)2 c.淀粉 d.甲基橙
②Cl元素的质量分数为(列出算式)________________。
③若取消步骤III,会使步骤IV中增加一个化学反应,该反应的离子方程式为________;该反应使测定结果________(填“偏大”“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向浓度均为 0.1mol·L1、体积均为100mL的两种一元酸HA、HB的溶液中,分别加入固体NaOH,溶液中的lg![]() 随加入 NaOH 的物质的量的变化如图所示。下列说法正确的是
随加入 NaOH 的物质的量的变化如图所示。下列说法正确的是

A.由水电离出的 c(H+)的顺序为:c﹥a﹥b
B.b 点时酸碱恰好完全中和
C.c 点溶液中:c(B)﹥c(HB)
D.常温下电离常数:HA﹤HB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知HA的酸性弱于HB的酸性。25℃时,用NaOH固体分别改变物质的量浓度均为0.1 molL-1的HA溶液和HB溶液的pH(溶液的体积变化忽略不计),溶液中A-、B-的 物质的量浓度的负对数与溶液的pH的变化悄况如图所示。

下列说法正确的是( )
A. 曲线Ⅰ表示溶液的pH与-lgc(A-)的变化关系
B. ![]()
C. 溶液中水的电离程度:M>N
D. N点对应的溶液中c(Na+)>Q点对应的溶液中c(Na+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com