
【题目】下列物质一定属于同系物的( )
①![]() ②
②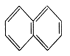 ③
③![]() ④C2H4 ⑤CH2=CH-CH=CH2 ⑥C3H6 ⑦
④C2H4 ⑤CH2=CH-CH=CH2 ⑥C3H6 ⑦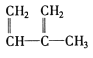 ⑧
⑧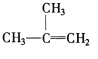
A.④和⑥B.①、②和③C.⑤和⑦D.④⑥和⑧
 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
【题目】环境问题已经是我国面临的重大问题.
Ⅰ![]() 减少二氧化碳的排放是一项重要课题.研究表明,
减少二氧化碳的排放是一项重要课题.研究表明,![]() 经催化加氢可合成低碳醇:
经催化加氢可合成低碳醇:![]() 几种化学键的键能如表所示
几种化学键的键能如表所示
化学键 |
|
|
|
|
|
|
键能 | 803 | 436 | 332 | 409 | 463 | 326 |
通过计算得出![]() ______ .
______ .
![]() 在
在![]() 恒容密闭容器中投入
恒容密闭容器中投入![]() 和
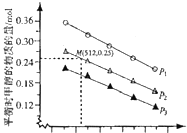
和![]() 发生该反应,实验测得不同温度及压强下,平衡时甲醉的物质的量如图所示.
发生该反应,实验测得不同温度及压强下,平衡时甲醉的物质的量如图所示.
当压强为![]() ,温度为512K时,向该容器中投入
,温度为512K时,向该容器中投入![]() 、
、![]()
![]() 、2mol
、2mol![]() 、
、![]()
![]() 时,平衡向 ______ 方向移动.
时,平衡向 ______ 方向移动.
![]() 以
以![]() 、空气
、空气![]() 含量
含量![]() 、KOH溶液为原料,以石墨为电极可直接构成燃料电池,则该电池的负极反应式为 ______ ;用该电池电解
、KOH溶液为原料,以石墨为电极可直接构成燃料电池,则该电池的负极反应式为 ______ ;用该电池电解![]()
![]() 溶液,当燃料电池消耗标况下56L空气时,计算理论上两极电解产生气体的总物质的量 ______ .
溶液,当燃料电池消耗标况下56L空气时,计算理论上两极电解产生气体的总物质的量 ______ .
Ⅱ![]() 也是一种大气污染物,可以用海水处理含
也是一种大气污染物,可以用海水处理含![]() 的废气,海水中主要离子的含量如下:
的废气,海水中主要离子的含量如下:
成分 | 含量 | 成分 | 含量 |
| 18980 |
| 400 |
| 10560 |
| 142 |
| 2560 |
| 1272 |
![]() 海水经初步处理后,还含有
海水经初步处理后,还含有![]() 、
、![]() ,
,![]() 、
、![]() ,向其中加入石灰浆使海水中的
,向其中加入石灰浆使海水中的![]() 转换为
转换为![]() ,当
,当![]() 刚好沉淀完全时,
刚好沉淀完全时,![]()
![]() 为 ______
为 ______ ![]()
已知![]()
![]()
![]() 处理过的废气中
处理过的废气中![]() 的含量可以通过碘量法来测定.用到的试剂有:
的含量可以通过碘量法来测定.用到的试剂有:![]() 的碘标准溶液,淀粉溶液.当把处理后的废气以每分钟
的碘标准溶液,淀粉溶液.当把处理后的废气以每分钟![]() 标况下
标况下![]() 的流速通入到100mL含有淀粉的碘标准液中,tmin达到滴定终点.滴定终点的现象为 ______ 计算该处理气中
的流速通入到100mL含有淀粉的碘标准液中,tmin达到滴定终点.滴定终点的现象为 ______ 计算该处理气中![]() 的含量 ______
的含量 ______ ![]() 用含a,t的式子表示
用含a,t的式子表示![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】深井岩盐的主要配料为:精制盐、碘酸钾(KIO3)、亚铁氰化钾[K4Fe(CN)6·3H2O]。其中亚铁氰化钾的无水盐在高温下会发生分解:3K4[Fe(CN)6]![]() 2(CN)2↑+12KCN+N2↑+Fe3C+C。请回答下列问题:
2(CN)2↑+12KCN+N2↑+Fe3C+C。请回答下列问题:
(1)①基态Fe原子价电子排布图(轨道表示式)为_________________________
②C、N和O三种元素的第一电离能的大小顺序为_____________,原因是__________。
③IO3-的中心原子的杂化方式为______。一种与CN-互为等电子体的分子的电子式为_______。
④1molFe(CN)63中含有σ键的数目为____mol。
(2)配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=___。Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于__________(填晶体类型)。
(3)如图是从铁氧体离子晶体Fe3O4中取出的能体现其晶体结构的一个立方体,该立方体中三价铁离子处于氧离子围成的________(填空间结构)空隙。
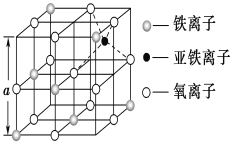
(4)Fe能形成多种氧化物,其中FeO晶胞结构为NaCl型。晶体中实际上存在空位、错位、杂质原子等缺陷,晶体缺陷对晶体的性质会产生重大影响。由于晶体缺陷,在晶体中Fe和O的个数比发生了变化,变为FexO(x<1),若测得某FexO晶体密度为5.71gcm﹣3,晶胞边长为4.28×10﹣10 m,则FexO中x=____。(用代数式表示,不要求算出具体结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某![]() 、
、![]() 的混合溶液中加入少量的
的混合溶液中加入少量的![]() ,测得溶液中离子浓度的关系如图所示,下列说法正确的是
,测得溶液中离子浓度的关系如图所示,下列说法正确的是![]()
![]()
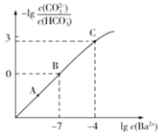
A.A,B,C三点对应溶液pH的大小顺序为:![]()
B.B点对应的溶液中存在:![]()
C.向C点溶液中通入![]() 可使C点溶液向B点溶液转化
可使C点溶液向B点溶液转化
D.该溶液中存在: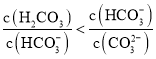
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向浓度均为 0.1mol·L1、体积均为100mL的两种一元酸HA、HB的溶液中,分别加入固体NaOH,溶液中的lg![]() 随加入 NaOH 的物质的量的变化如图所示。下列说法正确的是
随加入 NaOH 的物质的量的变化如图所示。下列说法正确的是

A.由水电离出的 c(H+)的顺序为:c﹥a﹥b
B.b 点时酸碱恰好完全中和
C.c 点溶液中:c(B)﹥c(HB)
D.常温下电离常数:HA﹤HB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气),下列说法正确的是
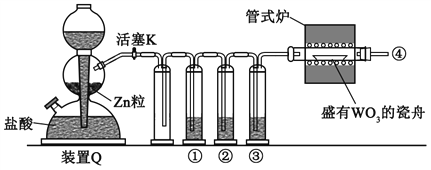
A. ①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液
B. 管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度
C. 结束反应时,先关闭活塞K,再停止加热
D. 装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是( )
A. 甲烷的燃烧热为 890.3 kJ/mol,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ/mol
B. 500℃、30MPa 下,将 0.5mol N2和 1.5molH2置于密闭容器中充分反应生成 NH3(g),放热 19.3 kJ,其热化学方程式为:N2(g)+3H2(g) ![]() 2NH3(g) △H = -38.6 kJ/mol
2NH3(g) △H = -38.6 kJ/mol
C. 稀盐酸和 稀氢氧化钠溶液混合, 其热化学方程式为:H+(aq)+OH-(aq)=H2O(1) △H = -57.3 kJ/mol
D. 1molH2完全燃烧放热 142.9kJ,则氢气燃烧的热化学方程式为: 2H2(g)+O2(g)=2H2O(1)△H =+285.8 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述正确的是
A. 苯和氯气生成C6H6Cl6的反应是取代反应
B. 乙烯与溴水发生加成反应的产物是CH2CH2Br2
C. 等物质的量的甲烷与氯气反应的产物是CH3Cl
D. 硫酸作催化剂,CH3CO18OCH2CH3水解所得乙醇分子中有18O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)![]() NaNO3(s)+NOCl(g) K1 △H1<0 (Ⅰ)
NaNO3(s)+NOCl(g) K1 △H1<0 (Ⅰ)
2NO(g)+Cl2(g)![]() 2NOCl(g) K2 △H2<0 (Ⅱ)
2NOCl(g) K2 △H2<0 (Ⅱ)
(1)4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=______(用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=______(用K1、K2表示)。
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1molCl2,10min时反应(Ⅱ)达到平衡。测得10min内v(NOCl)=7.5×10-3mol/(Lmin),则平衡后n(Cl2)=______ mol,NO的转化率α1=______。其他条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2______α1(填“>”“<”或“=”),平衡常数K2_____(填“增大”“减小”或“不变”)。若要使K2减小,可采取的措施是______。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2molNaOH的水溶液与0.2molNO2恰好完全反应得1L溶液A,溶液B为0.1mol/L的CH3COONa溶液,则两溶液中c(NO3-)、c(NO2-)和c(CH3COO-)由大到小的顺序为_________。(已知HNO2的电离常数Ka=7.1×10-4mol/L,CH3COOH的电离常数Ka=1.7×10-5mol/L)。
(4)可使溶液A和溶液B的pH相等的方法是________。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com