
【题目】研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)![]() NaNO3(s)+NOCl(g) K1 △H1<0 (Ⅰ)
NaNO3(s)+NOCl(g) K1 △H1<0 (Ⅰ)
2NO(g)+Cl2(g)![]() 2NOCl(g) K2 △H2<0 (Ⅱ)
2NOCl(g) K2 △H2<0 (Ⅱ)
(1)4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=______(用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=______(用K1、K2表示)。
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1molCl2,10min时反应(Ⅱ)达到平衡。测得10min内v(NOCl)=7.5×10-3mol/(Lmin),则平衡后n(Cl2)=______ mol,NO的转化率α1=______。其他条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2______α1(填“>”“<”或“=”),平衡常数K2_____(填“增大”“减小”或“不变”)。若要使K2减小,可采取的措施是______。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2molNaOH的水溶液与0.2molNO2恰好完全反应得1L溶液A,溶液B为0.1mol/L的CH3COONa溶液,则两溶液中c(NO3-)、c(NO2-)和c(CH3COO-)由大到小的顺序为_________。(已知HNO2的电离常数Ka=7.1×10-4mol/L,CH3COOH的电离常数Ka=1.7×10-5mol/L)。
(4)可使溶液A和溶液B的pH相等的方法是________。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
【答案】![]() 0.025 75%
0.025 75% ![]()
![]() 升高温度 c(NO3-)>c(NO2-)>c(CH3COO-)
升高温度 c(NO3-)>c(NO2-)>c(CH3COO-) ![]()
【解析】
(1)依据化学平衡常数概念,结合反应化学方程式书写平衡常数,结合平衡常数表达式计算得到平衡常数关系;
(2)根据反应速率概念计算v=![]() 计算Cl2的平衡浓度,根据转化率概念的计算,转化率=
计算Cl2的平衡浓度,根据转化率概念的计算,转化率=![]() ×100%,计算NO的平衡转化率;反应(II)在恒压条件下进行,随反应进行,气体体积减小,为保持恒压所以容器体积减小,压强增大,平衡正向进行,平衡时NO的转化率α2增大;平衡常数随温度变化,不随浓度、压强变化,若要使K2减小,平衡逆向进行,反应是放热反应,依据平衡移动原理应升高温度,平衡逆向进行,平衡常数随温度变化;
×100%,计算NO的平衡转化率;反应(II)在恒压条件下进行,随反应进行,气体体积减小,为保持恒压所以容器体积减小,压强增大,平衡正向进行,平衡时NO的转化率α2增大;平衡常数随温度变化,不随浓度、压强变化,若要使K2减小,平衡逆向进行,反应是放热反应,依据平衡移动原理应升高温度,平衡逆向进行,平衡常数随温度变化;
(3)0.2mol NaOH的水溶液与0.2molNO2恰好完全反应得1L溶液A,由2NO2+2NaOH═NaNO3+NaNO2+H2O,得到溶液A中NaNO3物质的量浓度为0.1mol/L,NaNO2物质的量为0.1mol/L;
(4)HNO2的电离常数Ka=7.1×10-4mol/L,CH3COOH的电离常数Ka=1.7×10-5mol/L,说明CH3COOH酸性小于HNO2的酸性,溶液中醋酸根离子水解程度小于亚硝酸根离子水解程度,溶液B碱性大于A溶液。
(1)①2NO2(g)+NaCl(s)![]() NaNO3(s)+NOCl(g),△H1<0 (I),平衡常数K1=
NaNO3(s)+NOCl(g),△H1<0 (I),平衡常数K1=![]() ;
;
②2NO(g)+Cl2(g)![]() 2NOCl(g) △H2<0,平衡常数K2 =
2NOCl(g) △H2<0,平衡常数K2 =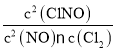 ;
;
③4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= ,计算得到K=
,计算得到K=![]() ;
;
(2)在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1molCl2,10min时反应(Ⅱ)达到平衡,测得10min内v(ClNO)=7.5×10-3mol/(Lmin),其物质的量n(ClNO)= 7.5×10-3mol/(Lmin)×10min×2L=0.15mol,则根据物质反应转化关系可知反应消耗NO的物质的量为n(NO)=n(ClNO)=0.15mol,反应消耗Cl2的物质的量为n(Cl2)=![]() n(ClNO)=
n(ClNO)=![]() ×0.15mol= 0.075mol,所以平衡时氯气的物质的量n(Cl2)=0.mol-0.075mol=0.025mol;NO的转化率α1=
×0.15mol= 0.075mol,所以平衡时氯气的物质的量n(Cl2)=0.mol-0.075mol=0.025mol;NO的转化率α1=![]() ×100%=75%;其他条件保持不变,反应(Ⅱ)在恒压条件下进行,随反应进行,气体体积减小,为保持恒压所以容器体积减小,压强增大,平衡正向进行,平衡时NO的转化率α2增大;平衡常数只与温度有关,不随浓度、压强变化,温度不变,化学平衡常数K2不变;若要使K2减小,平衡逆向进行,由于该反应的正反应是放热反应,根据平衡移动原理应升高温度,平衡逆向进行;
×100%=75%;其他条件保持不变,反应(Ⅱ)在恒压条件下进行,随反应进行,气体体积减小,为保持恒压所以容器体积减小,压强增大,平衡正向进行,平衡时NO的转化率α2增大;平衡常数只与温度有关,不随浓度、压强变化,温度不变,化学平衡常数K2不变;若要使K2减小,平衡逆向进行,由于该反应的正反应是放热反应,根据平衡移动原理应升高温度,平衡逆向进行;
(3)0.2mol NaOH的水溶液与0.2molNO2恰好完全反应得1L溶液A,由2NO2+2NaOH=NaNO3+NaNO2+H2O,得到溶液A中NaNO3物质的量浓度为0.1mol/L,NaNO2物质的量为0.1mol/L,溶液B为0.1mol/L的CH3COONa溶液;NaNO3是强酸强碱盐,不水解,c(NO3-)=0.1mol/L;CH3COOH、HNO2都是弱酸,HNO2的电离常数Ka=7.1×10-4molL-1,CH3COOH的电离常数Ka=1.7×10-5molL-1,说明CH3COOH酸性小于HNO2的酸性,溶液中醋酸根离子水解程度大于亚硝酸根离子水解程度,离子水解程度越大,溶液中离子浓度就越小,溶液B碱性大于A溶液,所以c(CH3COO-)<c(NO2-)<0.1mol/L,则两溶液中c(NO3-)、c(NO2-)和c(CH3COO-)由大到小的顺序为c(NO3-)>c(NO2-)>c(CH3COO-);
(4)欲使溶液A和溶液B的pH相等,
a.溶液B碱性大于A溶液,向溶液A中加适量水,稀释溶液,碱性减弱,不能调节使两个溶液pH相等,a错误;
b.向溶液A中加适量NaOH,增大碱性,可以调节溶液pH相等,b正确;
c.向溶液B中加适量水,稀释溶液碱性减弱,可以调节溶液pH相等,c正确;
d.溶液B碱性大于A溶液,向溶液B中加适量NaOH,B溶液pH更大,d错误;
故合理选项是bc。


科目:高中化学 来源: 题型:
【题目】下列物质一定属于同系物的( )
①![]() ②
②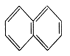 ③
③![]() ④C2H4 ⑤CH2=CH-CH=CH2 ⑥C3H6 ⑦
④C2H4 ⑤CH2=CH-CH=CH2 ⑥C3H6 ⑦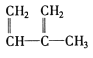 ⑧
⑧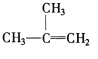
A.④和⑥B.①、②和③C.⑤和⑦D.④⑥和⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国制碱工业的先驱——侯德榜先生发明了著名的侯氏制碱法,其核心反应原理可用如下化学方程式表示:NH3+CO2+NaCl+H2O→NH4Cl+NaHCO3(晶体)。依据此原理,欲制得碳酸氢钠晶体,某校学生设计了如下实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和。

(1)A装置中所发生反应的离子方程式为___。C装置中稀硫酸的作用为___。
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100g水)
温度 溶解度 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
参照表中数据,请分析B装置中使用冰水的目的是___。
(3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在___装置与___装置之间(填写字母)连接一个盛有___的洗气装置,其作用是___。
(4)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.04g,则NaHCO3的产率为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质溶液在电解质储罐和电池间不断循环.下列说法不正确的是
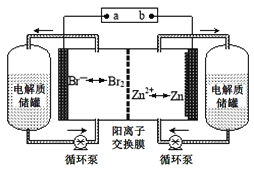
A.阳离子交换膜可阻止Br2与Zn直接发生反应
B.放电时正极的电极反应式为Br2+2e-=2Br-
C.充电时电极b连接电源的正极
D.放电时左侧电解质储罐中的离子总浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下列A、B、C、D、E五种粒子(原子或离子)的结构示意图,回答有关问题。

(1)与离子相对应的元素的符号是_________,与原子相对应的离子的结构示意图是__________
(2)电子层结构相同的是(填写代号,在本小题中下同)_______,性质最稳定的是______,最容易失去电子的是_______,最容易得到电子的是_______。
(3)可直接相互结合形成化合物的化学式是_______,可经过得失电子后再相互结合形成化合物的化学式是__________。
(4)在核电荷数1~10的元素内,列举两个与B电子层结构相同的离子,写出离子的符号_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是25 ℃时某些盐的溶度积常数和弱酸的电离平衡常数,下列说法正确的是
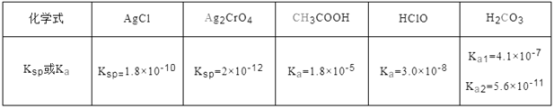
A. 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B. 碳酸钠溶液中滴加少量氯水的离子方程式H2O+2CO32-+Cl2===2HCO3-+Cl-+ClO-
C. 向0.1 mol·L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=9:5,此时溶液pH=5
D. 向浓度均为1×10-3mol·L-1的KCl和K2CrO4混合液中滴加1×10-3mol· L-1的AgNO3溶液,CrO42-先形成沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某食用香料乙酸橙花酯的结构简式如图所示,则关于该有机物叙述中正确的个数是( )

①分子式为C12H20O2 ②它的同分异构体中有芳香族化合物 ③能使酸性KMnO4溶液褪色 ④1mol该有机物在一定条件下能和3mol H2反应 ⑤密度比水小 ⑥1mol该有机物水解时能消耗1molNaOH⑦能在一定条件下生成高分子化合物
A. 3个 B. 4个 C. 5个 D. 6个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL。则下列说法正确的是( )

A.OH-由A端移向B端
B.0<V≤22.4L时,电池总反应的化学方程式为:CH4 + 2O2 + KOH = KHCO3 + 2H2O
C.22.4L<V≤44.8L时,负极电极反应为:CH4 - 8e- + 9CO32- + 3H2O = 10HCO3-
D.V=33.6L时,溶液中阴离子浓度大小关系为:c(CO32- )>c(HCO3- )>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①298K时K(HF)=3.5×10-4,Ksp(CaF2)=1.8×10-7
②HF(aq)![]() H+(aq)+F-(aq)△H<0
H+(aq)+F-(aq)△H<0
根据以上已知信息判断下列说法正确的是( )
A. 298K时,加蒸馏水稀释HF溶液, ![]() 保持不变
保持不变
B. 308K时,HF的电离常数Ka>3.5×10-4
C. 298K时,向饱和CaF2溶液中加入少量CaCl2,Ksp(CaF2)会减小
D. 2HF(aq)+Ca2+(aq)![]() CaF2(s)+2H+(aq)K≈0.68
CaF2(s)+2H+(aq)K≈0.68
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com