
【题目】观察下列A、B、C、D、E五种粒子(原子或离子)的结构示意图,回答有关问题。

(1)与离子相对应的元素的符号是_________,与原子相对应的离子的结构示意图是__________
(2)电子层结构相同的是(填写代号,在本小题中下同)_______,性质最稳定的是______,最容易失去电子的是_______,最容易得到电子的是_______。
(3)可直接相互结合形成化合物的化学式是_______,可经过得失电子后再相互结合形成化合物的化学式是__________。
(4)在核电荷数1~10的元素内,列举两个与B电子层结构相同的离子,写出离子的符号_______________
【答案】O、Mg 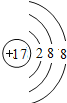 、
、 A和D、B和C及E BCE D A BE AD N3-、F-、Na+、Mg2+、Al3+
A和D、B和C及E BCE D A BE AD N3-、F-、Na+、Mg2+、Al3+
【解析】
(1)原子或离子结构示意图中,如果核内质子数不等于核外电子数,则该结构示意图为离子结构示意图,如果核外电子数等于核内质子数,则为原子结构示意图,A、B、C、D、E分别是Cl、O2-、Ne、Na、Mg2+,则B和E表示的是离子,对应的元素是O、Mg;Ne为稀有气体原子,不形成离子,Cl、Na原子对应的离子结构示意图分别为 、
、 ;
;
(2)电子层结构相同的是A和D、B和C及E,最外层电子达到稳定结构时该微粒性质最稳定,所以性质最稳定的是BCE;最外层电子数越少,越容易失电子,最易失电子的是D;最外层电子数越多(但小于8)越容易得电子,最易电子的是A,故答案为:A和D、B和C及E;BCE;D;A;
(3)阴阳离子可以相互化合得到离子化合物,所以B、E可以相互化合得到化合物;活泼金属原子和活泼非金属原子可以通过得到电子得到离子化合物,A、D可以通过得失电子形成化合物,故答案为:BE;AD;
(4)在核电荷数为1-10的元素内,与B的电子层结构相同的离子有F-、Na+、Mg2+、Al3+等,故答案为:N3-、F-、Na+、Mg2+、Al3+。


科目:高中化学 来源: 题型:
【题目】(Ⅰ)已知在448 ℃时,反应H2(g)+I2(g)![]() 2HI(g)的平衡常数K1为49,则该温度下反应2HI(g)
2HI(g)的平衡常数K1为49,则该温度下反应2HI(g)![]() H2(g)+I2(g)的平衡常数K2为________;反应1/2H2(g)+1/2I2(g)
H2(g)+I2(g)的平衡常数K2为________;反应1/2H2(g)+1/2I2(g)![]() HI(g)的平衡常数K3为______________________________________。
HI(g)的平衡常数K3为______________________________________。
(Ⅱ)在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=________。
(2)该反应为________(填“吸热”或“放热”)反应。
(3)能判断该反应达到化学平衡状态的依据是________。
A.容器中压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为________ ℃。
(5)在800 ℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2 mol·L-1,c(H2)为1.5 mol·L-1,c(CO)为1 mol·L-1,c(H2O)为3 mol·L-1,则下一时刻,反应将________(填“正向”或“逆向”)进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素A、B、C、D、E、F的原子序数依次增大,它们的原子核外电子层数之和为13;B的化合物种类繁多,数目庞大;C、D 是空气中含量最多的两种元素,D、E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期半径最小的元素。试回答以下问题:
(1)写出D与E以1:1的原子个数比形成的化合物的电子式:_______ ,F的原子结构示意图为_______。
(2)B、D形成的化合物 BD2中存在的化学键为_______ 键(填“离子”或“共价”,下同),A、C、F三种元素形成的化合物CA4F为_______化合物。
(3)化合物甲、乙由A、B、D、E中的三种或四种组成,且甲、乙的水溶液均呈碱性,则甲、乙反应的离子方程式为_______。
(4)A、C、D、E的原子半径由大到小的顺序是_______(用元素符号表示)。
(5)元素B和F的非金属性强弱,B的非金属性_______于F(填“强”或“弱”),并用化学方程式证明上述结论_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述中正确的是( )
A.常温常压下,11.2L氧气所含的原子数为NA
B.标准状况下,1.12L氦气所含的原子数为0.1NA
C.1.8 g NH4+离子中含有的电子数为NA
D.15.6 g Na2O2与过量CO2反应时,转移的电子数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
完成下列填空:
(1)硫原子的核外电子排布式为__,硫原子的核外电子占有__个轨道,Z元素在元素周期表中的位置为__,Y原子核外有______种能量不同的电子。
(2)H2S分子中H-S键键角为92°,说明H2S分子是__(填“极性”“非极性”)分子。
(3)下列事实能说明Y元素的非金属性比硫元素的非金属性强的是__。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1mol硫单质得电子多
c.Y和硫两元素的简单氢化物受热分解,前者的分解温度高
(4)X与Z两元素的单质反应生成0.1molX的最高价化合物,恢复至室温,放热68.7kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式___。
(5)碳酸钠溶液中滴入酚酞,溶液显红色,请用离子方程式解释产生该现象的原因:___;在上述红色的溶液中加入少许氯化钙固体,溶液颜色变浅,请用平衡理论解释产生该现象的原因___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在工农业生产和日常生活中有着广泛的用途。请回答下列问题:
(1)基态铜原子的核外电子排布式为___。
(2)NF3可由NH3和F2在Cu催化剂存在下反应直接得到:4NH3+3F2![]() NF3+3NH4F
NF3+3NH4F
①上述化学方程式中的5种物质所属的晶体类型有__![]() 填序号
填序号![]() 。
。
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
②F、N、O三种元素的第一电离能由大到小的顺序为__![]() 用元素符号表示
用元素符号表示![]()
(3)铜晶体铜原子的堆积方式为面心立方最密堆积。每个铜原子周围距离最近的铜原子数目为___。
(4)某X原子的外围电子排布式为3s23p5,铜与X形成化合物的晶胞如图所示(黑点代表铜原子)。
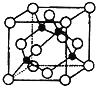
![]() 该晶体的化学式为___。
该晶体的化学式为___。
②已知该晶体的密度为ρg·cm-3,阿伏加德罗常数的数值为NA,则该晶体中晶胞的棱长为__pm(只写计算式![]() 。
。
(5)合成氨工艺的一个重要工序是铜洗,其目的是用铜液![]() 醋酸二氨合铜(I)、氨水
醋酸二氨合铜(I)、氨水![]() 吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其反应方程式为:Cu(NH3)2Ac+CO+NH3[Cu(NH3)3CO]Ac(Ac表示醋酸根
吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其反应方程式为:Cu(NH3)2Ac+CO+NH3[Cu(NH3)3CO]Ac(Ac表示醋酸根![]()
①如果要提高上述反应的反应速率,可以采取的措施是___。(选填编号)
a.减压 b.增加NH3的浓度 c.升温 d.及时移走产物
②铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为___。
③NH3的氮原子的杂化类型为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,加水冲稀时c(H+)/c(OH-)的值明显减小的溶液中,一定能大量共存的离子组是
①K+、Cl-、NO![]() 、CH3COO- ②Na+、Fe2+、I-、SO
、CH3COO- ②Na+、Fe2+、I-、SO![]()
③Ba2+、Cl-、NO![]() 、Na+ ④Na+、Ca2+、Cl-、HCO
、Na+ ④Na+、Ca2+、Cl-、HCO![]()
⑤K+、SO![]() 、Cl-、NO
、Cl-、NO![]()
A. ①③⑤ B. ②③ C. ②④ D. ②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如图。下列叙述正确的是( )
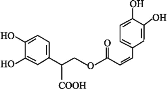
A.迷迭香酸的分子式为:C17H15O8
B.1 mol迷迭香酸最多能与9 mol氢气发生加成反应
C.迷迭香酸可以发生水解反应、取代反应和酯化反应
D.1 mol迷迭香酸最多能与含5 mol NaOH的水溶液完全反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com