
【题目】(Ⅰ)已知在448 ℃时,反应H2(g)+I2(g)![]() 2HI(g)的平衡常数K1为49,则该温度下反应2HI(g)
2HI(g)的平衡常数K1为49,则该温度下反应2HI(g)![]() H2(g)+I2(g)的平衡常数K2为________;反应1/2H2(g)+1/2I2(g)
H2(g)+I2(g)的平衡常数K2为________;反应1/2H2(g)+1/2I2(g)![]() HI(g)的平衡常数K3为______________________________________。
HI(g)的平衡常数K3为______________________________________。
(Ⅱ)在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=________。
(2)该反应为________(填“吸热”或“放热”)反应。
(3)能判断该反应达到化学平衡状态的依据是________。
A.容器中压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为________ ℃。
(5)在800 ℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2 mol·L-1,c(H2)为1.5 mol·L-1,c(CO)为1 mol·L-1,c(H2O)为3 mol·L-1,则下一时刻,反应将________(填“正向”或“逆向”)进行。
【答案】![]() 7
7 ![]() 吸热 BC 830 逆向
吸热 BC 830 逆向
【解析】
(Ⅰ)互为逆反应的平衡常数互为倒数,化学计量数为倍数关系时平衡常数为平方关系;
(Ⅱ)(1)平衡常数为生成物浓度幂之积与反应物浓度幂之积的比;
(2)温度升高,平衡向吸热的正反应方向移动,平衡常数变大;
(3)能判断该反应达到化学平衡状态的依据是一定条件下正逆反应速率是否相等,或各组分的浓度是否不再随时间的改变而改变;
(4)由表给平衡常数判断;
(5)判断反应800℃进行的方向时,根据平衡常数和浓度熵的大小判断反应进行的方向。
(Ⅰ) 反应2HI(g)![]() H2(g)+I2(g)与反应H2(g)+I2(g)
H2(g)+I2(g)与反应H2(g)+I2(g)![]() 2HI(g)互为逆反应,平衡常数互为倒数关系,则K2为
2HI(g)互为逆反应,平衡常数互为倒数关系,则K2为![]() =
=![]() ;反应
;反应![]() H2(g)+
H2(g)+![]() I2(g)
I2(g)![]() HI(g)的计量数为反应H2(g)+I2(g)
HI(g)的计量数为反应H2(g)+I2(g)![]() 2HI(g)的一半,则K3=
2HI(g)的一半,则K3=![]() =
=![]() =7,故答案为:
=7,故答案为:![]() ;7;
;7;
(Ⅱ) (1)平衡常数为生成物浓度幂之积与反应物浓度幂之积的比,则反应的平衡常数K=![]() ,故答案为:
,故答案为:![]() ;
;
(2)通过表中K和t的关系可知,温度越高,K值越大,说明升高温度,平衡向正反应方向移动,则正反应为吸热反应,故答案为:吸热;
(3)A、该反应为气体的物质的量不变的反应,则容器中压强始终不变,容器中压强不变不能说明反应达到平衡状态;
B、混合气体中c(CO)不变,说明反应达到平衡状态;
C、υ(H2)正=υ(H2O)逆,则对于氢气来说正逆反应速率相等,则反应达到平衡状态;
D、c(CO2)=c(CO),该反应不一定达到平衡,浓度关系取决于反应物的起始量和转化率;
故答案为:BC;
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),化学平衡常数K=![]() =1,此时温度由表中数据可知为830 ℃,故答案为:830;
=1,此时温度由表中数据可知为830 ℃,故答案为:830;
(5)800 ℃时,浓度熵Qc=![]() =
=![]() =1>0.9,所以反应向逆反应方向进行,故答案为:逆向。
=1>0.9,所以反应向逆反应方向进行,故答案为:逆向。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:
【题目】A.[物质结构与性质]
Cu2O广泛应用于太阳能电池领域。以CuSO4、NaOH和抗坏血酸为原料,可制备CuO。
(1)Cu2+基态核外电子排布式为____。
(2)![]() 的空间构型为____(用文字描述);Cu2+与OH反应能生成[Cu(OH)4]2,[Cu(OH)4]2中的配位原子为____(填元素符号)。
的空间构型为____(用文字描述);Cu2+与OH反应能生成[Cu(OH)4]2,[Cu(OH)4]2中的配位原子为____(填元素符号)。
(3)抗坏血酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为____;推测抗坏血酸在水中的溶解性:____(填“难溶于水”或“易溶于水”)。
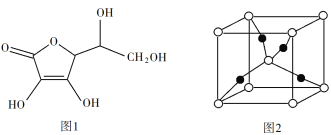
(4)一个Cu2O晶胞(见图2)中,Cu原子的数目为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于![]() 的说法正确的是
的说法正确的是
A. 最多有7个原子在同一直线上 B. 最多有7个碳原子在同一直线上
C. 所有碳原子可能都在同一平面上 D. 最多有18个原子在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、D、E、F为原子序数依次增大的五种短周期主族元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B单质在D单质中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A单质在F单质中燃烧,产物溶于水得到一种强酸。用相应的化学用语回答下列问题:
(1)F在周期表中的位置是___,E2D2的电子式为___。
(2)AFD的结构式为___,BD2的电子式为___。
(3)EDA的电子式为___,AF的电子式为___。
(4)B元素形成的化合物种类繁多的原因可能是(填序号)___。
①碳原子之间成键方式多样化,碳碳之间可以单键、双键或者叁键
②同分异构现象的普遍存在
③碳碳之间可以通过共价键彼此结合成链状或者环状
(5)元素D、E、F形成的简单离子的半径由大到小为__(用离子符号表示)。
(6)用电子式表示E与F形成化合物的过程___。
(7)写出E与D形成的既含离子键又含共价键的化合物与水反应的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组按下列路线合成镇痛药哌替啶M。

已知:ⅰ.R—NH2+![]()
![]() RNHCH2CH2OH
RNHCH2CH2OH
ⅱ.![]()
(1)A→B的化学方程式是__。
(2)B→C的反应类型是__。
(3)D的核磁共振氢谱只有一个吸收峰,其结构简式是__。
(4)D→E的化学方程式是__。
(5)G中含有两个六元环,其结构简式是__。
(6)I和H反应生成镇痛药哌替啶M的化学方程式是__。
(7)写出同时符合下列条件的C的同分异构体的结构简式__(写出一种即可)。
①分子中有苯环且是苯的邻位二取代物;
②核磁共振氢谱表明分子中有6种氢原子;红外光谱显示存在碳氮双键(C=N)。
(8)以C为原料可以合成重要的医药中间体对氨基苯乙酸,合成路线如下:
![]()
①写出Y的结构简式__。
②合成路线中反应条件Fe/HCl的作用是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式2SO2(g)+O2(g)![]() 2SO3(g) △H =-Q kJ·mol1(Q>0),则下列说法正确的是( )
2SO3(g) △H =-Q kJ·mol1(Q>0),则下列说法正确的是( )
A.2mol SO2(g)和1mol O2(g)所具有的总能量小于2mol SO3(g)所具有的能量
B.将2mol SO2(g)和1mol O2(g)置于一密闭容器中充分反应后放出Q kJ的热量
C.升高温度,平衡向逆反应方向移动,上述热化学方程式中的Q值减小
D.将一定量SO2(g)和O2(g)置于某密闭容器中充分反应后放热Q kJ,则此过程中有2molSO2(g)被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物之间的转化关系如图.
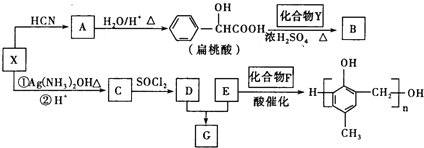
已知以下信息:
①RCHO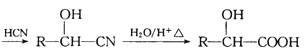
②RCOOH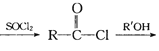 RCOOR’(R、R’代表烃基)
RCOOR’(R、R’代表烃基)
③X在催化剂作用下可与H2反应生成化合物Y
④化合物F的核磁共振氢谱图中只有一个吸收峰
回答下列问题:
(1)X的含氧官能团的名称是___,X与HCN反应生成A的反应类型是__。
(2)酯类化合物B的分子式是C15H14O3,其结构简式是__。
(3)G在NaOH溶液中发生水解反应的化学方程式是__。
(4)![]() 的同分异构体中:①能发生水解反应;②能发生银镜反应;③能与氯化铁溶液发生显色反应;④含氧官能团处在对位。满足上述条件的同分异构体共有__种(不考虑立体异构),写出核磁共振氢谱图中有五个吸收峰的同分异构体的结构简式__。
的同分异构体中:①能发生水解反应;②能发生银镜反应;③能与氯化铁溶液发生显色反应;④含氧官能团处在对位。满足上述条件的同分异构体共有__种(不考虑立体异构),写出核磁共振氢谱图中有五个吸收峰的同分异构体的结构简式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下列A、B、C、D、E五种粒子(原子或离子)的结构示意图,回答有关问题。

(1)与离子相对应的元素的符号是_________,与原子相对应的离子的结构示意图是__________
(2)电子层结构相同的是(填写代号,在本小题中下同)_______,性质最稳定的是______,最容易失去电子的是_______,最容易得到电子的是_______。
(3)可直接相互结合形成化合物的化学式是_______,可经过得失电子后再相互结合形成化合物的化学式是__________。
(4)在核电荷数1~10的元素内,列举两个与B电子层结构相同的离子,写出离子的符号_______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com