
【题目】锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质溶液在电解质储罐和电池间不断循环.下列说法不正确的是
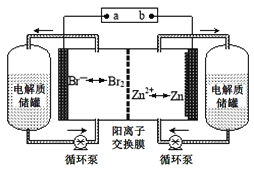
A.阳离子交换膜可阻止Br2与Zn直接发生反应
B.放电时正极的电极反应式为Br2+2e-=2Br-
C.充电时电极b连接电源的正极
D.放电时左侧电解质储罐中的离子总浓度增大
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】向某![]() 、
、![]() 的混合溶液中加入少量的
的混合溶液中加入少量的![]() ,测得溶液中离子浓度的关系如图所示,下列说法正确的是
,测得溶液中离子浓度的关系如图所示,下列说法正确的是![]()
![]()
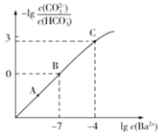
A.A,B,C三点对应溶液pH的大小顺序为:![]()
B.B点对应的溶液中存在:![]()
C.向C点溶液中通入![]() 可使C点溶液向B点溶液转化
可使C点溶液向B点溶液转化
D.该溶液中存在: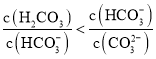
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述正确的是
A. 苯和氯气生成C6H6Cl6的反应是取代反应
B. 乙烯与溴水发生加成反应的产物是CH2CH2Br2
C. 等物质的量的甲烷与氯气反应的产物是CH3Cl
D. 硫酸作催化剂,CH3CO18OCH2CH3水解所得乙醇分子中有18O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:
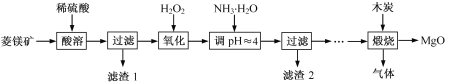
(1)MgCO3与稀硫酸反应的离子方程式为_______。
(2)加入H2O2氧化时,发生反应的化学方程式为_______。
(3)滤渣2 的成分是_______(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁苯酞是我国自主研发的一类用于治疗急性缺血性脑卒的新药。合成丁苯酞(J)的一种路线如下:


(1)A的名称是_______________,A分子中最多有_____个原子共平面。
(2)B生成A的化学方程式______________________。
(3)D生成E的反应类型为_________,试剂a是_________。
(4)F的结构简式_____________________。
(5)J是一种酯,分子中除苯环外还含有一个五元环。写出H生成J的化学方程式_____(注明反应条件)。
(6)![]() ,X的同分异构体中:①能发生银镜反应;②能与氯化铁溶液发生显色反应。满足上述条件的X的同分异构体共有______种,写出其中核磁共振氢谱有五组吸收峰的结构简式___________________。
,X的同分异构体中:①能发生银镜反应;②能与氯化铁溶液发生显色反应。满足上述条件的X的同分异构体共有______种,写出其中核磁共振氢谱有五组吸收峰的结构简式___________________。
(7)利用题中信息和所学知识,写出以甲烷和化合物D为原料,合成 ![]() 的路线流程图____________________(其它试剂自选)。
的路线流程图____________________(其它试剂自选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法正确的是( )
A.22.4L甲烷分子所含质子数为10NA
B.标准状况下,22.4L二氯甲烷的分子数约为NA个
C.1mol苯分子中含有的碳碳单键数为6NA
D.常温常压下,28.0g乙烯和丁烯的混合气体中含有的碳原子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)![]() NaNO3(s)+NOCl(g) K1 △H1<0 (Ⅰ)
NaNO3(s)+NOCl(g) K1 △H1<0 (Ⅰ)
2NO(g)+Cl2(g)![]() 2NOCl(g) K2 △H2<0 (Ⅱ)
2NOCl(g) K2 △H2<0 (Ⅱ)
(1)4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=______(用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=______(用K1、K2表示)。
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1molCl2,10min时反应(Ⅱ)达到平衡。测得10min内v(NOCl)=7.5×10-3mol/(Lmin),则平衡后n(Cl2)=______ mol,NO的转化率α1=______。其他条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2______α1(填“>”“<”或“=”),平衡常数K2_____(填“增大”“减小”或“不变”)。若要使K2减小,可采取的措施是______。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2molNaOH的水溶液与0.2molNO2恰好完全反应得1L溶液A,溶液B为0.1mol/L的CH3COONa溶液,则两溶液中c(NO3-)、c(NO2-)和c(CH3COO-)由大到小的顺序为_________。(已知HNO2的电离常数Ka=7.1×10-4mol/L,CH3COOH的电离常数Ka=1.7×10-5mol/L)。
(4)可使溶液A和溶液B的pH相等的方法是________。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某芳香族酯类化合物甲的分子式为C14H10O5,1 mol甲水解后只生成一种产物乙,其物质的量为2 mol,下列说法正确的是( )
A. 符合上述条件的甲共有3种B. 1 mol甲最多可以和3 mol NaOH反应
C. 乙不能和溴水发生反应D. 2 mol乙最多可以和1 mol Na2CO3反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烷、乙烯等有机物在工业上有广泛的应用,回答下列问题:
(1)已知:①C3H8(g)+5O2(g)= 3CO2(g)+4H2O(l) △H1
②C(石墨,s)+O2(g)= CO2(g) △H2
③2H2(g)+O2(g)= 2H2O(l) △H3
写出丙烷气体(C3H8)分解得到石墨(C)和氢气的热化学方程式:___。
(2)煤制乙烯包括合成气制备、合成气制甲醇、甲醇分解三步,则:
①生产合成气的反应:C(s)+H2O(g)=CO(g)+H2(g)在高温下能自发进行,则该反应的___(填选项)。
a.△H>0 △S>0 b.△H>0 △S<0
c.△H<0 △S>0 d.△H>0 △S<0
②用合成气制备甲醇的反应为:CO(g)+ 2H2(g)![]() CH3OH(g)(不发生其他反应)。四个容器中起始时压强、容积均相同,维持恒温,控制条件如下表;
CH3OH(g)(不发生其他反应)。四个容器中起始时压强、容积均相同,维持恒温,控制条件如下表;
编号 | 条件控制 | CO(g)/moL | H2(g)/moL | CH3OH(g)/moL |
A | 维持恒容 | 0.2 | 0.4 | 0 |
B | 维持恒容 | 0.1 | 0.2 | 0.1 |
C | 维持恒容 | 0.4 | 0.8 | 0 |
D | 维持恒压 | 0.4 | 0.8 | 0 |
达到平衡时,四个容器中甲醇的体积分数由大到小的关系是___(用字母表示)。
(3)在两个容积均为1L的密闭容器中以不同的氢碳比[n(H2)/n(CO2)]充入H/span>2和CO2,在一定条件下发生反应:2CO2(g)+ 6H2(g)![]() C2H4(g)+ 4H2O(g)△H。CO2的平衡转化率α(CO2)与温度的关系如图所示。
C2H4(g)+ 4H2O(g)△H。CO2的平衡转化率α(CO2)与温度的关系如图所示。
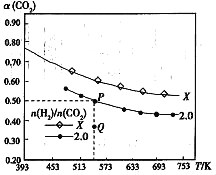
①此反应的平衡常数表达式K=___,P点对应温度下,K的值为___。
②该反应的△H___0(填“>”“<”或“=”),判断的理由是___。
③氢碳比:X___2.0(填“>”“<”或“=”)。
④在氢碳比为2.0时,Q点v(逆)___P点的v(逆)(填“>”“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com