
【题目】下面是利用盐桥电池从某些含碘盐中提取碘的两个装置, 下列说法中正确的是
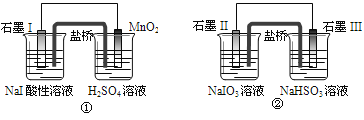
A.两个装置中石墨I和石墨II作负极
B.碘元素在装置①中被氧化,在装置②中被还原
C.①中MnO2的电极反应式为:MnO2+2H2O+2e-==Mn2++4OH
D.反应①、②中生成等量的I2时导线上通过的电子数之比为1∶5
科目:高中化学 来源: 题型:
【题目】乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中正确的是

①分子式为C12H20O2
②能使酸性KMnO4溶液褪色
③能发生加成反应,但不能发生取代反应
④它的同分异构体中可能有芳香族化合物,且属于芳香族化合物的同分异构体有8种
⑤1mol该有机物水解时只能消耗1molNaOH
⑥1mol该有机物在一定条件下和H2反应,共消耗H2为3mol
A.①②③ B.①②⑤ C.①②⑤⑥ D.①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以炼锌烟尘(主要成份为ZnO,含少量CuO和FeO)为原料,可以制取氯化锌和金属锌。
Ⅰ、制取氯化锌主要工艺如下:
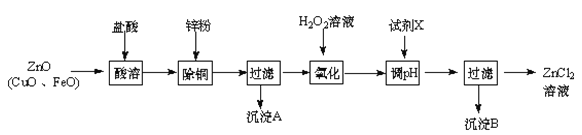
已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。

(1)加入H2O2溶液发生反应的离子方程式为 。
(2)流程图中,为了降低溶液的酸度,试剂X可以是 (选填序号:a.ZnO;b.Zn(OH)2 ;c.Zn2(OH)2CO3 ;d.ZnSO4);pH应调整到 。
(3)氯化锌能催化乳酸(![]() )生成丙交酯(C6H8O4)和聚乳酸,丙交酯的结构简式为 ,聚乳酸的结构简式为 。
)生成丙交酯(C6H8O4)和聚乳酸,丙交酯的结构简式为 ,聚乳酸的结构简式为 。
Ⅱ、制取金属锌采用碱溶解{ZnO(s)+2NaOH(aq)+H2O(l)=Na2[Zn(OH)4](aq)},然后电解浸取液。
(4)以石墨作电极电解时,阳极产生的气体为 ;阴极的电极反应为 。
(5)炼锌烟尘采用碱溶,而不采用酸溶后电解,主要原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常常利用物质的酸碱性分离混合物.某一混合物含苯酚、苯甲醇、苯甲酸和苯胺四种物质,其分离方案如图。

已知:①苯胺(![]() )有弱碱性,可与盐酸等反应生成盐;
)有弱碱性,可与盐酸等反应生成盐;
②常温下,苯胺、苯酚、苯甲酸、苯甲醇微溶于水,但均易溶于有机溶剂。
回答下列问题:
(1)写名称:物质2是 ,物质4是 。
(2)写出A、C的化学式:A , C 。
(3)写出反应②的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
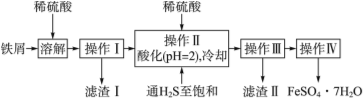
查询资料,得有关物质的相关数据如表:
25 ℃时 | pH[] |
饱和H2S溶液 | 3.9 |
SnS沉淀完全 | 1.6 |
FeS开始沉淀 | 3.0 |
FeS沉淀完全 | 5.5 |
(1)操作Ⅱ中,通入硫化氢至饱和的目的是_______;在溶液中用硫酸酸化至pH=2的目的是________。
(2)滤渣Ⅱ的主要成分是__________。
(3)操作Ⅳ得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;②_____________________________。
(4)测定绿矾产品中Fe2+含量的方法是:a.称取2.850 g绿矾产品,溶解,在250 mL容量瓶中定容;b.量取25.00 mL待测溶液于锥形瓶中;c.用硫酸酸化的0.010 00 mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00 mL。
①滴定时盛放KMnO4溶液的仪器为__________(填仪器名称)。
②判断此滴定实验达到终点的方法是____________________________。
③计算上述样品中FeSO4·7H2O的质量分数为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.下列说法中正确的是 。
A.丙烯分子中有8个σ键,1个π键
B.在SiO2晶体中,1个Si原子和2个O原子形成2个共价键
C.NF3的沸点比NH3的沸点低得多,是因为NH3分子间有氢键,NF3只有范德华力
D.NCl3和BC13分子中,中心原子都采用sp3杂化
II.人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测是钛(Ti),它被誉为“未来世纪的金属”。试回答下列问题:
(1)Ti元素在元素周期表中的位置是第______周期第___ ____族,
其基态原子的电子排布式为________。
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定。偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如图所示,它的化学式是 ,其中Ti4+的氧配位数为 ,Ba2+的氧配位数为 ;

(3)常温下的TiCl4是有刺激性臭味的无色透明液体,熔点-23.2℃,沸点136.2℃,所以TiCl4应是 化合物,其固体是 晶体。TiCl4在潮湿空气中易挥发,水解而冒白烟,这是因为水解后有________生成。
(4)已知Ti3+可形成配位数为6的配合物,其空间构型为正八面体,如下图1所示,我们通常可以用下图2所示的方法来表示其空间构型(其中A表示配体,M表示中心原子)。配位化合物[Co(NH3)4Cl2]的空间构型也为八面体型,它有 种同分异构体,请在下图方框中将其画出。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿立呱陛(A)是一种新的抗精神分裂症药物,可由化合物B、C、D在有机溶剂中通过以下两条路线合成得到。

(1) E的结构简式为 ,其含氧官能团有 (写名称)。
(2)由C, D生成化合物F的反应类型是 。化合物C与足量的NaOH乙醇溶液共热反应的产物的名称是 。
(3)H属于氨基酸,与B的水解产物互为同分异构体。H能与FeCl3溶液发生显色反应,且苯环上的一氯代物只有2种。写出两种满足上述条件的H的结构简式: 、 。
(4)合成F(相对分子质量为366)时还可能生成一种相对分子质量为285的副产物G,G能使溴水褪色,G的结构简式为 。
(5)已知: 写出由C制备化合物
写出由C制备化合物
的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,我国利用生产磷铵排放的废渣磷石膏制取硫酸并联产水泥的技术研究获得成功。已知磷灰石的主要成分是Ca3(PO4)2,具体生产流程如图:

回答下列问题:
(1)装置a用磷酸吸收NH3。若该过程在实验室中进行,请画出装置a的示意图:_____。
(2)热交换器是实现冷热交换的装置。化学实验中也经常利用热交换来实现某种实验目的,如气、液热交换时通常使用的仪器是_______________。
(3)依题意猜测固体A中一定含有的物质的化学式是___________(结晶水部分不写)。
(4)利用生产磷铵排放的废渣磷石膏制取硫酸,其中SO2生产硫酸的工艺流程图如图所示:

①在A处二氧化硫被氧化成三氧化硫,设备A的名称是___________,设备A中发生反应的化学方程式是______________。为提高三氧化硫的产率,该处应采用_____(填“等温过程”或“绝热过程”)为宜。
②在D处进行二次催化处理的原因是_______________________。
③B处气体混合物主要是氮气和三氧化硫.此时气体经过C后不立即进入D是因为:___________。
④20%的发烟硫酸(SO3的质量分数为20%)1吨需加水_______吨(保留2位有效数字)才能配制成98%的成品硫酸。
(5)制硫酸所产生的尾气除了含有N2、O2外,还含有SO2,微量的SO3和酸雾。能用于测定硫酸尾气中SO2含量的是___________________。
A.NaOH溶液、酚酞试液 B.KMnO4溶液、稀硫酸
C.碘水、淀粉溶液 D.氨水、酚酞试液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达到平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。
2SO3(g) ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达到平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。

则下列说法正确的是
A.由图甲知,A点SO2的平衡浓度为0.4 mol·L-1
B.由图甲知,B点SO2、O2、SO3的平衡浓度之比为2:1:2
C.达平衡后,缩小容器容积,则反应速率变化图象可以用图乙表示
D.压强为0.50 MPa时,不同温度下SO2转化率与温度关系如丙图,则T2>T1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com