
| A. | HClO是弱酸,所以NaClO是弱电解质 | |
| B. | CCl4可用于鉴别溴水和碘水 | |
| C. | 漂白粉在空气中不稳定,因此可用于漂白纸张 | |
| D. | 用乙醇萃取的方法可以分离溶于水的碘,是因为碘在乙醇中的溶解度较大 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.7 mol/(L.min) | B. | v(B)=0.3mol/(L.min) | ||
| C. | v(C)=0.9 mol/(L.min) | D. | v(D)=1.1mol/(L.min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
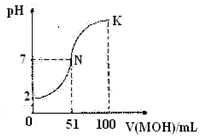
| A. | 在N到K间任意一点对应的溶液中:c(M+)+c(H+)=c(OHˉ)+c(Aˉ) | |
| B. | HA为弱酸 | |
| C. | 常温下,MA溶液的pH>7 | |
| D. | N点水的电离程度小于K点水的电离程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| X | |||
| W |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
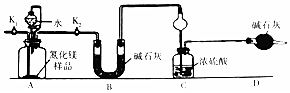
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com