
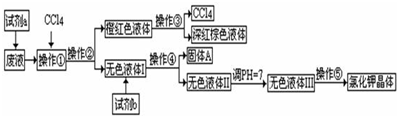


科目:高中化学 来源: 题型:
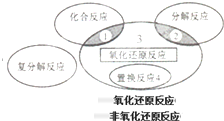
| A、4Fe(OH)2+O2+2H2O=4Fe(OH)3 | ||||
B、2NaHCO3
| ||||
C、4NH3+5O2
| ||||
| D、Zn+H2SO=ZnSO4+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ca(OH)2浊液与稀盐酸反应:Ca(OH)2+2H+=Ca2++2H2O |
| B、稀硫酸滴在铁片上:2Fe+6H+=2Fe3++3H2↑ |
| C、铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag |
| D、大理石溶于醋酸的反应:CaCO3+2H+=Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
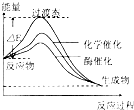
| A、此反应放热,在任何条件下都能自发进行 |
| B、催化剂只改变反应历程,不影响热效应 |
| C、任何温度下,酶催化反应速率均比化学催化反应速率快 |
| D、酶催化的效果比化学催化效果好,能让反应放出更多热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
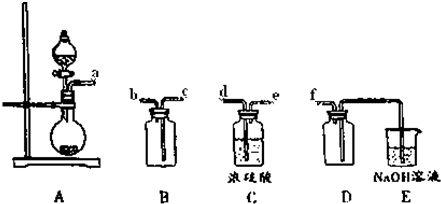
查看答案和解析>>
科目:高中化学 来源: 题型:
 .现有A、B、C、D、E、F六种有机物有如下转化,其中A的分子式为C4H8O3.下列判断正确的是( )
.现有A、B、C、D、E、F六种有机物有如下转化,其中A的分子式为C4H8O3.下列判断正确的是( )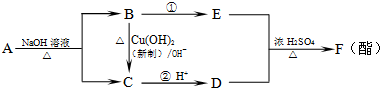
| A、有机物A结构可能有四种 |
| B、反应①属于氧化反应 |
| C、有机物B、D的最简式相同 |
| D、有机物E是交警检测酒驾的重要物证 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com