
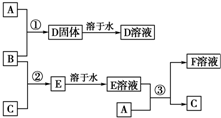
 室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适的反应条件下,它们可以按如图所示进行反应.又知E溶液是无色的,F溶液是浅绿色的.
室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适的反应条件下,它们可以按如图所示进行反应.又知E溶液是无色的,F溶液是浅绿色的.
| ||
| ||


科目:高中化学 来源: 题型:
 某无色透明溶液,可能含有下列离子:Mg2+、Al3+、Fe3+、Ba2+、H+、NH4+、SO42-、HCO3-、Cl-.取该溶液进行如下实验:
某无色透明溶液,可能含有下列离子:Mg2+、Al3+、Fe3+、Ba2+、H+、NH4+、SO42-、HCO3-、Cl-.取该溶液进行如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 盆烯是近年合成的一种有机物,它的分子结构可简化表示为(其中C、H原子已略去),下列关于盆烯的说法中错误的是( )
盆烯是近年合成的一种有机物,它的分子结构可简化表示为(其中C、H原子已略去),下列关于盆烯的说法中错误的是( )| A、盆烯是乙烯的一种同系物 |
| B、盆烯分子中所有的碳原子不可能在同一平面上 |
| C、盆烯是苯的一种同分异构体 |
| D、盆烯在一定条件下可以发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、纸上层析属于色谱分析法,其原理跟“毛细现象”相关,通常以滤纸作为惰性支持物,水作为固定相 |
| B、重结晶时,溶液冷却速度越慢得到的晶体颗粒越小 |
| C、用新制的Cu(OH)2浊液可以检验牙膏中的甘油,生成绛蓝色沉淀 |
| D、将3~4根火柴头浸于水中,片刻后取少量溶液于试管中,加AgNO3溶液和稀HNO3,可以检验火柴头中的氯元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com