
| 1 |
| 3 |
| c(N2O4) |
| c2(NO2) |
| 1mol |
| 3mol |
| ||
| 5min |
| c(N2O4) |
| c2(NO2) |
| 0.012 |
| 0.032 |
| 1 |
| 3 |
| 4mol |
| (10mol)2 |
| 1 |
| 3 |


 �����Ļ���������人������ϵ�д�
�����Ļ���������人������ϵ�д� ���������ּ���ÿһ��ȫ�º�����ҵ��ϵ�д�
���������ּ���ÿһ��ȫ�º�����ҵ��ϵ�д� ��ٽ������½������������ϵ�д�
��ٽ������½������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
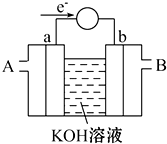 ��1����֪2Cu��s��+
��1����֪2Cu��s��+| 1 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
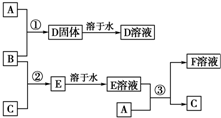 �����£�����A��B��C�ֱ�Ϊ���塢����ɫ���塢��ɫ���壬�ں��ʵķ�Ӧ�����£����ǿ�����ͼ��ʾ���з�Ӧ����֪E��Һ����ɫ�ģ�F��Һ��dz��ɫ�ģ�
�����£�����A��B��C�ֱ�Ϊ���塢����ɫ���塢��ɫ���壬�ں��ʵķ�Ӧ�����£����ǿ�����ͼ��ʾ���з�Ӧ����֪E��Һ����ɫ�ģ�F��Һ��dz��ɫ�ģ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����Ԫ��������ͬλ�� |
| B���ش���������Ϊ36��ͬλ�� |
| C���������ӵ�ƽ���������Ϊ72 |
| D����������С����Ԫ����ռԭ�Ӱٷ���Ϊ�ٷ�֮75 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����״���£�22.4L H2O���еķ�����Ϊ1NA |
| B�����³�ѹ�£�1.06g Na2CO3���е�Na+������Ϊ0.02NA |
| C��ͨ��״���£�1NA��CO2����ռ�е����Ϊ22.4L |
| D����0.5mol?/L��MgSO4��Һ�У�Mg2+��ĿΪ0.5NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����ϩ�������Ҵ�����ʹ��ɫ�����Ը��������Һ��ɫ |
| B����ϩ�;۱�ϩ������������һ�������·����ӳɷ�Ӧ |
| C����֬�ڼ�������¿ɷ���ˮ�⣬��ҵ�����ø÷�Ӧ�������� |
| D��������������֬�����ǡ������ʶ����Է���ˮ�ⷴӦ |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com