
【题目】(8分)氢气是未来最理想的能源之一,科学家最近研制出利用太阳能产生激光,并在二氧化钛(TiO2)表面作用使海水分解得到氢气的新技术:2H2O![]() 2H2↑+O2↑。制得的氢气可用于燃料电池。
2H2↑+O2↑。制得的氢气可用于燃料电池。
试回答下列问题:
(1)海水分解生成的氢气用于燃料电池时,实现________能转变为________能。水分解时,断裂的化学键为________键,分解海水的反应属于________反应(填“放热”或“吸热”)。
(2)某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,两极上发生的电极反应分别为:A极:2H2+2O2--4e-===2H2O;B极:O2+4e-===2O2-,则A极是电池的______极;电子从该极________(填“流入”或“流出”)。
(3)有人以化学反应:2Zn+O2+4H+===2Zn2++2H2O为基础设计出一种原电池,移入人体内作为心脏起搏器的能源,它们靠人体内血液中溶有一定浓度的O2、H+、Zn2+进行工作。则原电池的负极材料是______,正极上发生反应的电极反应式为 。
科目:高中化学 来源: 题型:
【题目】空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。下图为RFC工作原理示意图,有关说法正确的是
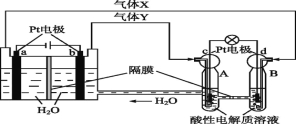
A.当有0.1 mol电子转移时,a极产生1.12 L O2(标准状况下)
B.b极上发生的电极反应是:4H2O+4e- =2H2↑+4OH-
C.c极上进行还原反应,B中的H+可以通过隔膜进入A
D.d极上发生的电极反应是:O2+4H++4e- =2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 熔融时能导电的物质一定是离子化合物
B. NaOH、H2SO4溶于水均克服了离子键
C. CO2、NCl3中所有原子最外层都满足8电子结构
D. 金刚石和足球烯是同素异形体,熔化只克服共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定。
Ⅰ.制备Na2S2O3·5H2O
反应原理:Na2SO3 (aq)+S(s)![]() Na2S2O3 (aq)
Na2S2O3 (aq)
实验步骤:
① 称取15 g Na2SO3加入圆底烧瓶中,再加入80 mL蒸馏水。 另取5 g研细的硫粉,用3 mL乙醇润湿,加入上述溶液中。
② 安装实验装置(如图所示,部分夹持装置略去),水浴加热, 微沸60分钟。

③ 趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3·5H2O,经过滤、洗涤、低温干燥,得到产品。
回答问题:
(1) Na2S2O3 中硫元素的化合价为_____________;Na2S2O3在强酸性溶液中不能稳定存在,其原因为___________________(用离子方程式表示)。
(2)仪器a的名称是________,其作用是________________。
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是________。检验其是否存在的方法是___________________。
Ⅱ.测定产品纯度
准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂, 用0.100 0 mol·L-1碘的标准溶液滴定(反应原理为:2S2O![]() +I2===S4O
+I2===S4O![]() +2I-)。
+2I-)。
(4)滴定至终点时,溶液颜色的变化:_____________。
(5)滴定结束后消耗碘的标准溶液体积为20.00mL。产品的纯度为(用含W的代数式表示)_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.摩尔是国际科学界建议采用的一种物理量
B.HNO3的摩尔质量是63g
C.我们把含有6.02×1023个粒子的任何粒子的集体计量为1摩尔
D.1mol氧含6.02×1023个O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。关于该电池的叙述正确的是( )

A.该电池能够在高温下工作
B.电池的负极反应为:C6H12O6+6H2O-24e-6CO2↑+24H+
C.放电过程中,H+从正极区向负极区迁移
D.在电池反应中,每消耗1 mol氧气,理论上能生成标准状况下CO2气体 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物用途广泛,研究硫及其化合物性质和用途意义重大。
⑴利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
已知:SO2(g)+1/2O2(g)![]() SO3(g) △H=-98 kJ·mol-1。某温度下该反应的平衡常数K=10/3。
SO3(g) △H=-98 kJ·mol-1。某温度下该反应的平衡常数K=10/3。
①该温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正) _________ v(逆)(填“<”、“>”或“=”)。
②该温度下,向一体积为2 L的恒容密闭容器中充入2.0 mol SO2和1.0 molO2,反应一段时间后容器压强为反应前的80%,此时SO2的转化率为_______________。
③在②中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是__________(填字母)。
A.保持温度和容器体积不变,充入1.0 mol O2
B.升高温度
C.保持温度和容器体积不变,充入1.0 mol SO3
D.增大容器体积
⑵室温下,Li /FeS2二次电池所用的电解质是非水液体电解质,放电行为与温度有关。
①该电池电解质为非水液体电解质,原因是___________________。
②温度低时,锂与FeS2反应只生成A物质,产生第一次放电行为;温度升高,锂与A继续反应(产生物之一为Fe),产生第二次放电行为。若二次行为均进行完全且放电量恰好相等,请写出化学反应方程式:第一次放电:__________________;第二次放电:________________。
⑶制取高纯度黄铁矿的另一种方法是:以LiCl—KCl低共熔点混合物为电解质,FeS为阳极,Al为阴极,在适当的电压下电解,写出阳极方程式______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com