
应用元素周期律分析下列推断,其中正确的组合是
①碱金属单质的熔点随原子序数的增大而降低
②砹(At)是第VIIA族,其氢化物的稳定性大于HCl
③硒(Se)的最高价氧化物对应水化物的酸性比硫酸弱
④第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性
⑤铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应
⑥第三周期金属元素的最高价氧化物对应水化物,其碱性随原子序数的增大而减弱

科目:高中化学 来源: 题型:
为了测定酸碱中和反应的中和热,计算时至少需要的数据是
①酸的浓度和体积 ②碱的浓度和体积 ③比热容 ④反应后溶液的质量
⑤生成水的物质的量 ⑥反应前后溶液温度变化 ⑦操作所需的时间
A.①②③⑥ B.①③④⑥ C.③④⑤⑥ D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
有短周期元素A、B、C、D、E、F六种短周期元素,其原子序数依次增大。其中A是周期表中原子半径最小的元素,B的核外有两个电子层,其核外电子数为两层电子数之差的三倍;A、E和D、F分别同族。D的最外层电子数等于B的原子序数。试根据以上叙述回答:
(1)写出元素符号:C____________、D____________、E_____________、F_____________;
(2)写出由A、D、E、F四种元素组成的两种盐反应的离子方程式________________________;
(3)C单质点燃时与B单质充分反应生成的淡黄色固态化合物与水反应的化学方程式:__________________;
(4)A与C的最低价形成的化合物为M:
① 设计简单实验验证M的浓溶液的酸碱性________________________。(写出操作、现象和结论)
②写出M催化氧化的化学方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
现在含有元素硒(Se)的保健品市场火热,已知硒元素与氧元素同主族,与钾元素同周期,则下列关于硒的叙述中不正确的是 ( )
A.原子序数为24 B.最高价氧化物的化学式为SeO3
C.非金属性比S弱 D.气态氢化物化学式为H2Se
查看答案和解析>>
科目:高中化学 来源: 题型:
氢化铵(NH4H)与氯化铵结构相似。已知NH4H与水反应有氢气产生,则下列叙述不正确的是
A.NH4H的电子式是: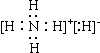
B.NH4H固体投入少量水中,有两种气体产生
C.NH4H中的H-离子半径比锂离子半径大
D.NH4H溶于水后,形成的溶液呈酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
已知元素的离子aAn+、bB(n+1)+、cCn-、dD(n+1)-均为由同周期主族元素形成的简单离子。下列正确的是( )
A.原子半径C>D>A>B B.原子序数C>D>B>A
C.离子半径D>C>B>A D.单质的还原性A>B>C>D
查看答案和解析>>
科目:高中化学 来源: 题型:
为达到预期的实验目的,下列操作正确的是
A.欲配制质量分数为10%的ZnSO4溶液,将10 g ZnSO4·7H2O溶解在90 g水中
B.欲制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸
C.为鉴别KCl、AlCl3和MgCl2溶液,分别向三种溶液中滴加NaOH溶液至过量
D.为减小中和滴定误差,锥形瓶必须洗净并烘干后才能使用
查看答案和解析>>
科目:高中化学 来源: 题型:
某课外活动小组同学用下图装置进行实验,一段时间后在C电极表面有铜析出,试回答下列问题。
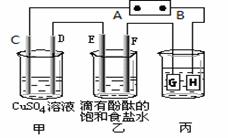
(1)A为电源的 极;
(2)E的电极反应式为: ;
(3)在常温下,现用丙装置给铁镀铜,当丙中铁表面析出铜的3.2g时,乙中溶液的PH值为 (假设溶液体积为1L);
(4)在电解一段时间后在甲中加入适量 可以使溶液恢复到原来的浓度。
(5)利用反应2Cu+O2+2H2SO4===2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com