
某课外活动小组同学用下图装置进行实验,一段时间后在C电极表面有铜析出,试回答下列问题。
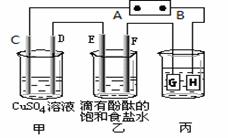
(1)A为电源的 极;
(2)E的电极反应式为: ;
(3)在常温下,现用丙装置给铁镀铜,当丙中铁表面析出铜的3.2g时,乙中溶液的PH值为 (假设溶液体积为1L);
(4)在电解一段时间后在甲中加入适量 可以使溶液恢复到原来的浓度。
(5)利用反应2Cu+O2+2H2SO4===2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为______________。
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
应用元素周期律分析下列推断,其中正确的组合是
①碱金属单质的熔点随原子序数的增大而降低
②砹(At)是第VIIA族,其氢化物的稳定性大于HCl
③硒(Se)的最高价氧化物对应水化物的酸性比硫酸弱
④第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性
⑤铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应
⑥第三周期金属元素的最高价氧化物对应水化物,其碱性随原子序数的增大而减弱

查看答案和解析>>
科目:高中化学 来源: 题型:
读下列药品标签,有关分析不正确的是
| 选项 | A | B | C | D | ||||||
| 物品标签 |
 | 药品:×××
|
 |
 | ||||||
| 分析 | 该试剂应装在橡胶塞的细口瓶中 | 该药品不能与皮肤直接接触 | 该物质受热易分解 | 该物质浓度为18.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,AgCl、AgBr、AgI的溶度积常数(Ksp)依次为1.8×10-10mol2·L-2、5.0×10-13mol2·L-2、8.3×10-17mol2·L-2。下列有关说法错误的是
A.常温下在水中溶解能力AgCl>AgBr>AgI
B.在AgCl饱和液中加入足量浓NaBr溶液有AgBr沉淀生成
C.在AgBr饱和溶液中加入NaCl固体不可能有AgCl沉淀生成
D.在AgI饱和液中加入NaI固体有AgI沉淀析出
查看答案和解析>>
科目:高中化学 来源: 题型:
把物质的量均为0.1mol的AlCl3、CuCl2和H2SO4溶于水制成100ml的混合溶液,用石墨做电极电解,并收集两电极所产生的气体,一段时间后在两极收集到的气体在相同条件下体积相同。则下列描述正确的是
A.电路中共转移0.9mol电子 B.阳极得到的气体中有O2且其物质的量为0.35mol
C.阴极质量增加3.2g D.铝元素以Al(OH)3的形式存在
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应A(g)+ 2 B(g)  3C(g)+ 4 D(g) ,在四种不同情况下的反应速率如下,其中反应进行得最快的是
3C(g)+ 4 D(g) ,在四种不同情况下的反应速率如下,其中反应进行得最快的是
A.v(A)= 0.15 mol/(L·min ) B.v(B)= 0.5 mol/(L·min)
C.v(C)= 0.4 mol/(L·min) D.v(D)= 0.02 mol/(L·s))源:学
查看答案和解析>>
科目:高中化学 来源: 题型:
下列仪器中①漏斗;②容量瓶;③蒸馏烧瓶;④天平;⑤分液漏斗;⑥滴定管;⑦燃烧匙,常用于物质分离的是( )
A.①③④ B.①②⑥ C.①③⑤ D.③④⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com