
读下列药品标签,有关分析不正确的是
| 选项 | A | B | C | D | ||||||
| 物品标签 |
 | 药品:×××
|
 |
 | ||||||
| 分析 | 该试剂应装在橡胶塞的细口瓶中 | 该药品不能与皮肤直接接触 | 该物质受热易分解 | 该物质浓度为18.4mol/L |
科目:高中化学 来源: 题型:
有短周期元素A、B、C、D、E、F六种短周期元素,其原子序数依次增大。其中A是周期表中原子半径最小的元素,B的核外有两个电子层,其核外电子数为两层电子数之差的三倍;A、E和D、F分别同族。D的最外层电子数等于B的原子序数。试根据以上叙述回答:
(1)写出元素符号:C____________、D____________、E_____________、F_____________;
(2)写出由A、D、E、F四种元素组成的两种盐反应的离子方程式________________________;
(3)C单质点燃时与B单质充分反应生成的淡黄色固态化合物与水反应的化学方程式:__________________;
(4)A与C的最低价形成的化合物为M:
① 设计简单实验验证M的浓溶液的酸碱性________________________。(写出操作、现象和结论)
②写出M催化氧化的化学方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
为达到预期的实验目的,下列操作正确的是
A.欲配制质量分数为10%的ZnSO4溶液,将10 g ZnSO4·7H2O溶解在90 g水中
B.欲制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸
C.为鉴别KCl、AlCl3和MgCl2溶液,分别向三种溶液中滴加NaOH溶液至过量
D.为减小中和滴定误差,锥形瓶必须洗净并烘干后才能使用
查看答案和解析>>
科目:高中化学 来源: 题型:
科学解释能力是科学素养的重要组成部分。下列对实验现象或操作的解释不合理的是
| 操作及现象 | 解释 | |
| A | 在AgI饱和溶液中滴加0.1mol·L—1NaCl溶液,出现白色沉淀 | AgCl的溶解度或Ksp比AgI小,生成更难溶的AgCl沉淀 |
| B | 盛放浓NaOH溶液的试剂瓶用玻璃塞久后,瓶塞很难打开 | NaOH腐蚀玻璃,生成的硅酸钠将瓶口与瓶塞粘在一起 |
| C | 配制FeC13溶液时加入适量盐酸酸化 | 抑制Fe3+水解,防止所配制溶液变浑浊 |
| D | 将氯气通入紫色石蕊溶液中,溶液先变红,后褪色 | 氯气与水反应生成盐酸和次氯酸,溶液显酸性使石蕊溶液变红,次氯酸具有漂白性,使溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是
A. 由单质A转化为单质B,ΔH=+119kJ/mol,可知单质A比单质B稳定
B.灼热的碳与CO2反应既是氧化还原反应,又是生成物总能量高于反应物总能量的反应
C. 决定化学反应速率的根本因素是参加反应的各物质的结构和性质
D.对于一个可逆反应(ΔH<0)达到平衡后,升高温度可以增加活化分子的百分数,提高有效碰撞
的次数,使V正增大的倍数大于V逆增大的倍数,从而使化学反应平衡逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
某课外活动小组同学用下图装置进行实验,一段时间后在C电极表面有铜析出,试回答下列问题。

(1)A为电源的 极;
(2)E的电极反应式为: ;
(3)在常温下,现用丙装置给铁镀铜,当丙中铁表面析出铜的3.2g时,乙中溶液的PH值为 (假设溶液体积为1L);
(4)在电解一段时间后在甲中加入适量 可以使溶液恢复到原来的浓度。
(5)利用反应2Cu+O2+2H2SO4===2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E是位于短周期的主族元素。已知:①热稳定性:HmD>HmC;② 、
、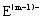 具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:
具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:
(1) HmDm的电子式___________________。
(2)  、
、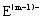 的还原性强弱顺序为:_________,能证明其还原性强弱的离子方程式为_________________________________________________________。
的还原性强弱顺序为:_________,能证明其还原性强弱的离子方程式为_________________________________________________________。
(3) 将E的单质通入A与D形成的化合物的水溶液中,其离子方程式为:
_________________________________________________________________。
(4) 常温下,将等物质的量浓度的HmC溶液和A的最高价氧化物对应的水化物溶液等体积混合,写出该反应的离子方程式 。在该溶液中溶质中含有的化学键类型是
(5) 在A、B、C、E单质中,符合下列转化关系的是_____________(填元素符号)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com