
| A. | Al | B. | Al(OH)3 | C. | AlCl3 | D. | Al2O3 |
分析 令各物质的质量分别为1g,根据方程式计算当体系中无固体物质时消耗碱的物质的量.
A、铝与氢氧化钠反应为2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
B、氢氧化铝与氢氧化钠反应为Al(OH)3+NaOH=NaAlO2+2H2O;
C、AlCl3与氢氧化钠反应为Al3++4OH-=AlO2-+2H2O;
D、Al2O3与氢氧化钠反应为Al2O3+2NaOH=2NaAlO2+2H2O.
解答 解:令各物质的质量分别为1g,
A.铝与氢氧化钠反应为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,1gAl消耗NaOH质量=$\frac{1g×80}{54}$=1.48g;
B.氢氧化铝与氢氧化钠反应为Al(OH)3+NaOH=NaAlO2+2H2O,1g氢氧化铝消耗氢氧化钠质量=$\frac{1g×40}{78}$=0.51g;
C.AlCl3与氢氧化钠反应为AlCl3+4NaOH=NaAlO2+3NaCl+2H2O,1g氯化铝消耗氢氧化钠质量=$\frac{1g×160}{133.5}$=1.2g;
D.Al2O3与氢氧化钠反应为Al2O3+2NaOH=2NaAlO2+H2O,1g氧化铝消耗氢氧化钠的质量=$\frac{1g×80}{102}$=0.78g,
相同质量的Al、Al(OH)3、Al2O3、AlCl3,Al(OH)3消耗NaOH最少,
故选B.
点评 本题考查铝及其化合物的性质、化学方程式有关计算,难度不大,注意基础知识的掌握.


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:选择题
| A. |  反应过程中能量关系可用图表示 | |
| B. | 该反应为自发反应 | |
| C. | 若将该反应设计成原电池则锌为负极 | |
| D. | 若将其设计为原电池,当有32.5g锌溶解时,正极放出气体为11.2L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 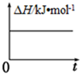 | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4$\stackrel{高温}{→}$C+2H2 | B. | 2HI+Cl2═2HCl+I2 | ||
| C. | CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O | D. | CH2Cl+Cl2$\stackrel{光}{→}$CH2Cl2+HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:As>C1>P | B. | 热稳定性:HC1>AsH3>HBr | ||
| C. | 还原性:As3->S2->C1- | D. | 酸性:H3AsO4>H2SO4>H3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数Ka | 1.8×10-5 | 4.9×10-10 | Ka1=4.3×10-7; Ka2=5.6×10-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com