
“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是
A.加热时,①上部汇集了固体NH4Cl,说明NH4Cl的热稳定性比较好
B.加热时,②、③溶液均变红,冷却后又都变为无色
C.④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅
D.四个“封管实验”中所发生的化学反应都是可逆反应
科目:高中化学 来源: 题型:
已知热化学方程式(Q1、Q2均为正值):
C(s)+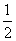 O2(g) = CO(g) ΔH=-Q1 kJ·mol-1,
O2(g) = CO(g) ΔH=-Q1 kJ·mol-1,
C(s)+O2(g) = CO2(g) ΔH=-Q2 kJ·mol-1,
有关上述反应的叙述错误的是
A.Q1<Q2 B.生成物总能量均高于反应物总能量
C.由1 mol C反应生成1 mol CO气体时放出Q1 kJ的热量
D.1 mol CO2气体具有的能量大于1 mol干冰具有的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
两种气态烃组成的混合物0.1 mol,完全燃烧得0.16 mol CO2和3.6 g H2O,则混合物中
A.一定有甲烷 B.一定有甲烷和乙烯(C2H4)
C.可能有乙烷(C2H6) D.一定有乙炔(C2H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏伽德罗常数的值,下列叙述正确的是
A.常温常压下,23g的NO2含有的氧原子数为NA
B.已知某种元素的一种原子的质量为ag,则该元素的相对原子质量近似为aNA
C.某密闭容器盛有0.1molN2和0.4molH2,在一定条件下充分反应,转移电子的数目为0.6NA
D.80gNH4NO3晶体中含有NH4+小于NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
向一定量的Fe、FeO、Fe3O4和Fe2O3的混合物中加入250mL 4mol/L的稀硝酸,恰好使混合物完全溶解。放出2.24L NO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现,若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为
A.0.21mol B.0.25mol C.0.45mol D.0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是向MgCl2、AlCl3混合溶液中,先后加入试剂A、B时所得沉淀物质的量y(mol) 与试剂体积V(mL)间的关系图.开始滴加6mL试剂A后继续滴加A若干,之后改滴试剂B。以下结论正确的是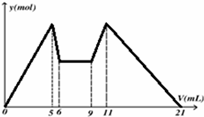
A可能是NaOH,B可能是盐酸,且2C(A)=C(B)
B.若A和B均为一元强酸或一元强碱,则滴加7mL试剂A后改滴试剂B
C.A可能是Ba(OH)2,B可能是硫酸,且C(A)=C(B)
D.原混合液中,c(Al3+):c(Mg2+):c(Cl-)=1:2:7
查看答案和解析>>
科目:高中化学 来源: 题型:
用二氧化氯、铁酸钠(Na2FeO4)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术,ClO2和Na2FeO4在水处理过程中分别被还原为Cl﹣和Fe3+。
(1)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么,ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是 ▲ > ▲ > ▲
(2)Na2FeO4溶于水会放出一种无色无味气体,其杀菌消毒、吸附水中的悬浮杂质的原理可用离子方程式表示为 ▲
(3)工业以CH3OH与NaClO3为原料在酸性条件下制取ClO2,同时产生CO2气体,已知该反应分为两步进行,第一步为2ClO3﹣+2Cl﹣+4H+=2ClO2↑+Cl2↑+2H2O
①写出第二步反应的离子方程式 ▲
②工业生产时需在反应物中加少量Cl﹣,其作用是 ▲
(4)已知二氧化氯是一种黄绿色有刺激性气味的气体,其熔点为﹣59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸在60℃时反应制得,ClO2也可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐。某学生用如图所示的装置模拟工业制取及收集ClO2,其中A为ClO2的发生装置,B为ClO2的凝集装置,C为尾气吸收装置。请问:
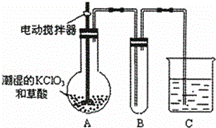
①A部分还应添加温度控制(如水浴加热)装置,B部分还应补充什么装置 ▲
②C中应装的试剂为 ▲ C中发生反应的化学方程式为: ▲
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是 ( )
A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
B.含1 mol Ba(OH)2的稀溶液和含1 mol H2SO4的稀溶液反应释放热量akJ,则表示该反应中和热的热化学反应方程式为:OH-(aq)+H+(aq)=H2O(l) H = -a kJ·mol-1
C.电解精炼铜时,电解初同一时间内,阳极溶解铜的质量比阴极析出铜的质量小
D.对于2HI(g) H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深,符合勒夏特列原理解释。
H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深,符合勒夏特列原理解释。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com