
【题目】研究煤的合理利用及CO2的综合应用有着重要的意义。请回答以下问题:
Ⅰ.煤的气化
已知煤的气化过程涉及的基本化学反应有:
①C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=+131 kJ/mol
CO(g)+H2(g) ΔH=+131 kJ/mol
②CO(g)+3H2(g)![]() CH4(g)+H2O(g) ΔH=a kJ/mol
CH4(g)+H2O(g) ΔH=a kJ/mol
查阅资料反应②中相关化学键键能数据如下表:
化学键 | C≡O | H-H | H-C | H-O |
E/(kJ/mol) | 1072 | 436 | 414 | 465 |
(1)则反应②中a=______。
(2)煤直接甲烷化反应C(s)+2H2 (g)![]() CH4(g)的ΔH为______kJ/mol,该反应在______(填“高温”或“低温”)下自发进行。
CH4(g)的ΔH为______kJ/mol,该反应在______(填“高温”或“低温”)下自发进行。
Ⅱ.合成低碳烯烃
在体积为1 L的密闭容器中,充入1 mol CO2和2.5 mol H2,发生反应: 2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH=-128 kJ/mol,测得温度对催化剂催化效率和CO2平衡转化率的影响如右图所示:
C2H4(g)+4H2O(g) ΔH=-128 kJ/mol,测得温度对催化剂催化效率和CO2平衡转化率的影响如右图所示:
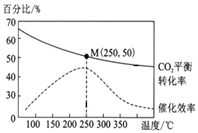
(3)图中低温时,随着温度升高催化剂的催化效率提高,但CO2的平衡转化率却反而降低,其原因是______。
(4)250℃时,该反应的平衡常数K值为______。
Ⅲ.合成甲醇
在恒温2 L容积不变的密闭容器中,充入1 molCO2和3 molH2,发生反应:CO2(g)+3H2(g) ![]() CH3OH(g) +H2O(g) ,测得不同时刻反应前后容器内压强变化(p后/p前)如下表:
CH3OH(g) +H2O(g) ,测得不同时刻反应前后容器内压强变化(p后/p前)如下表:
时间/h | 1 | 2 | 3 | 4 | 5 | 6 |
p后/p前 | 0.90 | 0.85 | 0.82 | 0.81 | 0.80 | 0.80 |
(5)反应前1小时内的平均反应速率v(H2)为______mol/(L·h),该温度下CO2的平衡转化率为______。
Ⅳ.电解逆转化制乙醇
(6)科研人员通过反复实验发现:CO2可以在酸性水溶液中电解生成乙醇,则生成乙醇的反应发生在______极(填“阴”或“阳”),该电极的反应式为______。
【答案】-206 -75 低温 该反应ΔH<0,温度升高,平衡向逆反应方向移动,所以CO2的平衡转化率降低 1 0.3 40% 阴 2CO2+12H++12e-=CH3CH2OH+3H2O
【解析】
(1)根据反应热等于旧键断裂吸收的能量与新键形成释放的能量的差值计算;
(2)根据盖斯定律分析解答;反应若自发进行,则△G=ΔH-TΔS<0;
(3)根据温度对催化剂的催化活性和对化学平衡移动影响分析CO2转化率的变化;
(4)利用化学平衡常数定义式计算;
(5)根据在恒容密闭容器内,气体的压强比等于气体的物质的量的比,计算出H2物质的量的改变值,再根据速率的定义计算;同时利用变化关系计算出平衡时CO2改变的物质的量,利用物质的转化率为质量除以起始量,计算出该温度下CO2的平衡转化率;
(6)根据阳极发生氧化反应,阴极发生还原反应,结合溶液的酸碱性书写电极反应式。
(1)根据反应方程式CO(g)+3H2(g)![]() CH4(g)+H2O(g) ΔH=a kJ/mol,可知ΔH=(1072+3×436-4×414-2×465)kJ/mol=-206kJ/mol;
CH4(g)+H2O(g) ΔH=a kJ/mol,可知ΔH=(1072+3×436-4×414-2×465)kJ/mol=-206kJ/mol;
(2)①+②,整理可得:C(s)+2H2 (g)![]() CH4(g)的ΔH=+131 kJ/mol-206kJ/mol=-75kJ/mol;该反应是气体体积减小的放热反应,根据体系的自由能公式△G=ΔH-TΔS,若反应自发进行,则△G=ΔH-TΔS<0,所以温度较低时△G<0,反应自发进行;
CH4(g)的ΔH=+131 kJ/mol-206kJ/mol=-75kJ/mol;该反应是气体体积减小的放热反应,根据体系的自由能公式△G=ΔH-TΔS,若反应自发进行,则△G=ΔH-TΔS<0,所以温度较低时△G<0,反应自发进行;
(3)由图分析可知在250℃时催化剂活性最大,在低于该温度时,升高温度,催化剂活性增强;而CO2的平衡转化率却随温度的升高反而降低,是由于该反应的正反应为放热反应,升高温度,化学平衡向吸热的逆反应方向移动,使反应物CO2转化率降低;
(4)在250℃时CO2转化率为50%,根据起始时加入的物质的物质的量及反应2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)中各种物质的转化关系可知,达到平衡时各种物质的平衡浓度分别为c(CO2)=0.5mol/L;c(H2)=1.0mol/L;c(C2H4)=0.25mol/L;c(H2O)=1.0mol/L,则该温度下的化学平衡常数K=
C2H4(g)+4H2O(g)中各种物质的转化关系可知,达到平衡时各种物质的平衡浓度分别为c(CO2)=0.5mol/L;c(H2)=1.0mol/L;c(C2H4)=0.25mol/L;c(H2O)=1.0mol/L,则该温度下的化学平衡常数K=![]() ;
;
(5)化学反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)
C2H4(g)+4H2O(g)
n(开始)/mol 1 3 0 0
1h△n/mol x 3x x x
△n(平衡)/mol y 3y y y
在1h时气体的总物质的量n=(1-x)+(3-3x)+x+x=(4-2x)mol,开始时总物质的量为4mol,根据![]() ,解得x=0.2mol,所以H2改变的物质的量为3×0.2mol=0.6mol, v(H2)=
,解得x=0.2mol,所以H2改变的物质的量为3×0.2mol=0.6mol, v(H2)=![]() mol/(Lh);
mol/(Lh);
在平衡时气体的总物质的量n=(1-y)+(3-3y)+y+y=(4-2y)mol,开始时总物质的量为4mol,根据![]() ,解得y=0.4mol,所以CO的平衡转化率=(0.4mol÷1mol)×100%=40%;
,解得y=0.4mol,所以CO的平衡转化率=(0.4mol÷1mol)×100%=40%;
(6)CO2中的C化合价为+4价,乙醇CH3CH3OH中C的平均化合价为-2价,化合价降低,获得电子,所以生成乙醇的反应发生在阴极,在酸性条件下,CO2在阴极获得电子,变为乙醇,电极反应式为:2CO2+12H++12e-=CH3CH2OH+3H2O。


科目:高中化学 来源: 题型:
【题目】现将 2 mol 气体A 与 1 mol 气体B 充入一个体积不变的容器内,发生反应:2A+B C+3D+4E,达到平衡后气体A 的浓度减少一半,发现有液体生成,在相同的温度下测得反应 前后压强分别为 6.06×106 Pa 和 8.08×106 Pa,又测得反应共放出热量 Q kJ,下列说法正确的是( )
A. 该反应在任何温度下都可自发进行
B. 在上述平衡体系中再加入 1 mol A 和 0.5 mol B,平衡正向移动,A 的转化率增大
C. 该反应的热化学方程式为 2A(g)+B(g) C(g)+3D(l)+4E(g) ΔH= -Q kJ/mol
D. 上述反应达到平衡后,其他的条件不变的情况下,升高温度,压强一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列说法正确的是( )
A. 标准状况下,11.2L的己烷所含的分子数为0.5NA
B. 28g乙烯所含共用电子对数目为4NA
C. 1mol羟基所含电子数为7 NA
D. 现有乙烯、丙烯的混合气体共14g,其原子数为3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2NaHCO3![]() Na2CO3 + H2O+CO2 ,现把14.8g Na2CO310H2O和NaHCO3组成的固体混合物溶于水配成100mL溶液,其中c(Na+)=1.2molL﹣1,若把等质量的固体混合物加热至恒重,残留固体质量是( )
Na2CO3 + H2O+CO2 ,现把14.8g Na2CO310H2O和NaHCO3组成的固体混合物溶于水配成100mL溶液,其中c(Na+)=1.2molL﹣1,若把等质量的固体混合物加热至恒重,残留固体质量是( )
A. 6.36gB. 3.18gC. 4.22gD. 5.28g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】赤泥是铝土矿提取氧化铝过程中产生的固体废弃物,其主要成分为Fe2O3、Al2O3、CaO、TiO2、SiO2等,属于强碱性废渣。从赤泥中回收钛的工艺流程如下:
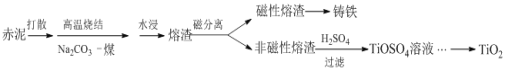
请回答以下问题:
(1)赤泥颗粒孔隙大,具有较大的比表面积,可作为废气SO2的吸收剂,研究表明该过程中主要利用了化学中和反应,其次是______。
(2)赤泥加一定量水打散的目的是______。
(3)已知高温烧结时,TiO2发生的反应是Na2CO3+TiO2 ![]() Na2TiO3+CO2↑,且Na2TiO3不溶于水。则Al2O3在烧结中发生的反应是______,水浸液里的主要溶质有______。
Na2TiO3+CO2↑,且Na2TiO3不溶于水。则Al2O3在烧结中发生的反应是______,水浸液里的主要溶质有______。
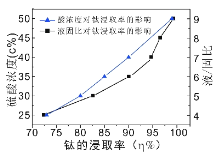
(4)酸浸时,若使钛的浸出率(η%)达到90%,则根据右图工业上应采取的适宜条件是:酸浓度和液固比的取值分别约为______、______。同时浸出温度过高可能造成的环境污染是__________。
(5)TiO2在一定条件下可转化为TiCl4而获得精制提纯,控制TiCl4水解的条件还可以制得TiO2·xH2O纳米材料,该水解过程的化学方程式是______。
(6)赤泥中含钛(以TiO2的质量分数表示)一般为4% ~12%,假设在上述工艺中钛的总回收率为75%,则1t赤泥获得TiO2的最大质量为______kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示是分离混合物时常用的仪器,回答下列问题:

(1)写出上述仪器的名称
A________, E________。
(2)分离以下混合物应该主要选用上述什么仪器?(填字母符号)
①粗盐和泥沙:________;②花生油和水:______。
(3)关于仪器的使用,下列说法不正确的是________。
A.A仪器可以用酒精灯直接加热
B.B仪器可以用于过滤
C.C仪器在放出液体时应打开上边的塞子
D.在实验室应用D仪器进行实验时要不断用玻璃棒搅拌
E.蒸馏时,E仪器中水的流向是上口进,下口出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于硝酸的认识,不正确的是
A.浓硝酸和稀硝酸都具有氧化性B.铜与硝酸的反应属于置换反应
C.硝酸可氧化Fe2+D.可用铁或铝制品盛装浓硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱金属和卤素随着原子序数的增大,下列递变规律正确的是( )
A.碱金属单质的熔、沸点逐渐降低B.卤素单质的熔、沸点逐渐降低
C.碱金属单质的密度逐渐增大D.卤素单质的密度逐渐减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com