
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:





 ;在一定条件下可水解为
;在一定条件下可水解为 ,F在强酸和长时间加热条件下发生水解反应的化学方程式是
,F在强酸和长时间加热条件下发生水解反应的化学方程式是

查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 某学生设计如图所示实验装置利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应,反应后温度将升高),A中盛浓盐酸,C中盛潮湿的消石灰,据此回答下列问题:
某学生设计如图所示实验装置利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应,反应后温度将升高),A中盛浓盐酸,C中盛潮湿的消石灰,据此回答下列问题:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
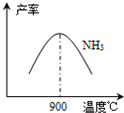 (3)N2和H2在铁作催化剂作用下从145℃就开始反应,不同温度下NH3产率如图所示.温度高于900℃时,NH3产率下降的原因
(3)N2和H2在铁作催化剂作用下从145℃就开始反应,不同温度下NH3产率如图所示.温度高于900℃时,NH3产率下降的原因
| ||
| △ |
| ||
| △ |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2010-2011学年河南省郑州外国语高三上学期第二次月考(理综)化学部分 题型:填空题
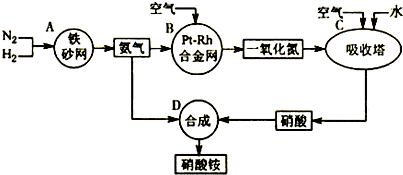
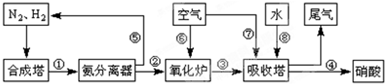
(16分)工业合成氨与制备硝酸一般可连续生产,流程如下:

(1)工业生产时,制取氢气的一个反应为:CO+H2O(g) CO2+H2。t℃时,往1L密闭容器中充入0.2mol
CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_____(填计算结果)。
CO2+H2。t℃时,往1L密闭容器中充入0.2mol
CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_____(填计算结果)。
(2)合成塔中发生反应N2(g)+3H2(g) 2NH3(g) △H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1____300℃(填“>”、“<”或“=”)。
2NH3(g) △H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1____300℃(填“>”、“<”或“=”)。
|
T/℃ |
T1 |
300 |
T2 |
|
K |
1.00×107 |
2.45×105 |
1.88×103 |
(3)N2和H2在铁作催化剂作用下从145℃就开始反应,不同温度下NH3产率如图所示。温度高于900℃时,NH3产率下降的原因 。

(4)在上述流程图中,氧化炉中发生反应的化学方程式为
__________ _。
(5)硝酸厂的尾气直接排放将污染空气。目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H= -574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H= -1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:________________________ 。
(6)氨气在纯氧中燃烧,生成一种单质和水,试写出该反应的化学方程式____________________,科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极是__________(填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com