
����Ŀ���������ֶ�����Ԫ����ɵĵ���a��b��c�����Ԫ������X��Y��Z������֮���ת����ϵ��ͼ��ʾ����֪:X��a��bԪ�ص�ԭ�Ӹ�����Ϊ1:1��������L��һ����ɫ����״Һ�塣����˵������ȷ����
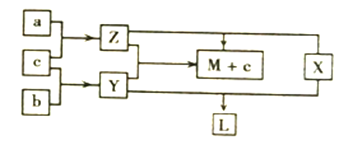
A. b��c������������Ԫ������ͬ����Ԫ�� B. X��Y��Z������һ�������м��Թ��ۼ�
C. L��Y��Z��������������֮�������Ӧ D. ͬ��ͬŨ�ȵ�ˮ��Һ������ǿ��Ϊ:L>Y>Z
���𰸡�C
��������������L��һ����ɫ����״Һ�壬L��Ũ���X��Y��Ӧ�������ᣬX��a��bԪ�ص�ԭ�Ӹ�����Ϊ1:1����X��H2O2��Y��SO2�� b��c����SO2����a��HԪ�أ�b��OԪ�ء�c��SԪ�أ�Z��H2S��H2S�� SO2��Ӧ����ˮ��S������M��H2O��O��SԪ�����ڢ�A��Ԫ������A��ȷ��H2O2��SO2��H2S�����ж����м��Թ��ۼ�����B��ȷ��������SO2����Ӧ����C��������H2SO4> H2SO3> H2S����D��ȷ��


 ���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д�
���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д� ����ѵ��ϵ�д�
����ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
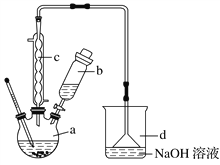
����Ŀ���屽��һ�ֻ���ԭ�ϣ�ʵ���Һϳ��屽��װ��ʾ��ͼ���й��������£�
�� | �� | �屽 | |
�ܶ�/g��cm��3 | 0.88 | 3.10 | 1.50 |
�е�/�� | 80 | 59 | 156 |
ˮ���ܽ�� | �� | �� | �� |
�����кϳɲ���ش����⣺
��1����a�м���15 mL��ˮ����������м����b��С�ļ���4.0 mLҺ̬�塣��a�е��뼸���壬�а�ɫ��������������Ϊ������________���壻�����μ���Һ����ꣻװ��d��������________________��
��2��Һ�����������в�������ᴿ��
����a�м���10 mLˮ��Ȼ����˳�ȥδ��Ӧ����м��
����Һ������10 mLˮ��8 mL 10%��NaOH��Һ��10 mLˮϴ�ӡ�NaOH��Һϴ�ӵ�������_______________________________________________________��
����ֳ��Ĵ��屽�м�����������ˮ�Ȼ��ƣ����á����ˡ������Ȼ��Ƶ�Ŀ����____________________________________________ ��
��3�������Ϸ���������屽�л����е���Ҫ����Ϊ______��Ҫ��һ���ᴿ�����в����п��е���________(����ĸ)��
A.�ؽᾧ B.����
C.���� D.��ȡ
��4���ڸ�ʵ���У�a���ݻ����ʺϵ���________(����ĸ)��
A.25 mL B.50 mL
C.250 mL D.500 mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧʵ���ǽ��л�ѧ�о�����Ч��������ش�����ʵ���е��й����⡣
I������ͼ��ʾ��װ�òⶨ�к��ȡ�

ʵ��ҩƷ��100mL 0.50 molL-1���ᡢ100mL 0.55 molL-1NaOH��Һ��
ʵ�鲽�裺�ԡ�
�ش��������⣺
��1����ʵ��װ���Ͽ�����ȱ�ٻ��β������������װ�õ�������____________����ͬѧ���������ͭ�ʽ������������Ƿ���ͬ��˵�����ɣ�________________��
��2������Ϊ��ʵ��ɹ��Ĺؼ���______________________________��
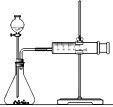
II��Ӱ�컯ѧ��Ӧ���ʵ����غܶ࣬ijУ������ȤС����ʵ��ķ�������̽�����ס���������ȤС������Mg��Fe��Cu�Ͳ�ͬŨ�ȵ����ᣨ0.5 molL-1��2 molL-1��18.4 molL-1�������ʵ�鷽�����о�Ӱ�췴Ӧ���ʵ����ء�
��1���������С������о���ʵ�鱨�棺
ʵ �� �� �� | �� �� | �� �� |
�ٷֱ�ȡ�����0.5 molL-1�������Թ��� �ڷֱ�Ͷ���С����״��ͬ��Mg��Fe��Cu �۹۲���������������Ŀ��� | �ٲ������������Mg>Fe ��Cu����������� | _________ |
���ݿ��Ʊ�������Ҫ�ó���ȷ��ʵ����ۣ���ʵ���������Ҫ�����¶Ⱥ�ѹǿ��ͬ��
��2����С��Ϊ�˸���ȷ���о�Ũ�ȶԷ�Ӧ���ʵ�Ӱ�죬������ͼװ�ý��ж���ʵ�顣��С��ѡ�õ�ʵ��ҩƷ�ǣ�Fe��2molL-1�����______molL-1���ᡣ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���F��һ���ٴ����õĻ���ҩ��й㷺����;����ϳ�·������:
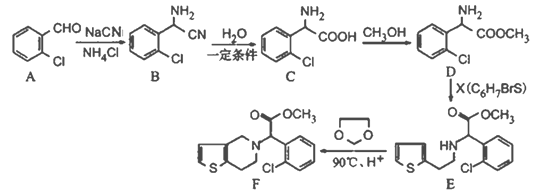
��1��д��B�ķ���ʽ________________��C�м��Թ����ŵ�����Ϊ____________________��
��2��д����A������ͬ�����ţ����ڷ����廯�������Һ���3�ֲ�ͬ��ѧ������ԭ�ӵ�ͬ���칹��Ľṹ��ʽ__________________________________��
��3��C��D�ķ�Ӧ������______________��X�Ľṹ��ʽΪ______________________��
��4������C���ӿ���һ�������·�Ӧ����һ�ֲ���ò�������к���3����Ԫ����д���÷�Ӧ�Ļ�ѧ����ʽ____________________________________��
��5����֪��
I.�����Ҵ����״�Ϊ�л�ԭ���Ʊ����� �����Ҫ�������еķ�Ӧ������____(��д���)��
�����Ҫ�������еķ�Ӧ������____(��д���)��
�ټӳɷ�Ӧ������ȥ��Ӧ����ȡ����Ӧ����������Ӧ���ݻ�ԭ��Ӧ��
II.д���Ʊ������� �����һ����Ӧ�Ļ�ѧ����ʽ________________________��
�����һ����Ӧ�Ļ�ѧ����ʽ________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ����ɫ��ĩ����BaCl2��K2SO4��CaCO3��NaOH��CuSO4��KCl�е�һ�ֻ�����ɣ�Ϊ��̽�����ijɷݣ�����������ʵ�飺
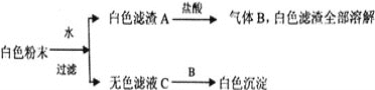
��1������B�Ļ�ѧʽ_____________,��ɫ�����ijɷ�Ϊ___________��
��2���ð�ɫ��ĩ��һ�����е�������___________________________��һ�������е�������____________�����ܺ��е�������______________��
��3��������Ҫȷ�����ܺ��е������Ƿ���ڣ�Ӧ��β�����____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA��ʾ�����ӵ�������ֵ������������ȷ���ǣ� ��
A. �����ʵ�����N2��CO������������ΪNA
B. �����£�0.1molCuSO4��5H2O��������ԭ����ĿΪ0.4 NA
C. NA��N2������ռ�������0.5NA��H2������ռ�������Ϊ2��1
D. �����£�1L 0.1mol��L-1��NH4NO3��Һ�е�ԭ����Ϊ0.2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʷ���ˮ�У�û��������ЧӦ����
A. �� B. �ƾ� C. ������ D. �����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ����ģ�ҵƯ��Һ����Ч�ɷ�ΪNaClO���ѳ���ˮ�а�����NH3�����������£�

���з�����ȷ����
A. ���в�������ķ������ƴ���ˮ
B. ������������Ҫ�缫��Ӧ��4OH- - 4e- = 2H2O + O2��
C. �����Ʊ�Ư��Һ�ķ�Ӧ��Cl2 + OH- = Cl- + HClO
D. �ڡ��ۡ����о�������������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����úϳ�������Ҫ�ɷ�ΪCO��CO2��H2���ڴ����������ºϳɼ״�������������Ӧ���£�
i. CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ��H1
CH3OH(g)+H2O(g) ��H1
ii. CO(g)+2H2(g)![]() CH3OH(g) ��H2
CH3OH(g) ��H2
iii. CO2(g)+H2(g)![]() CO (g)+H2O(g) ��H3
CO (g)+H2O(g) ��H3
�ش��������⣺
��1����֪��Ӧii�е���صĻ�ѧ�����ܣ���C![]() O����ʾCO�Ļ�ѧ�������ݼ�����
O����ʾCO�Ļ�ѧ�������ݼ�����
��ѧ�� | H-H | C-O | C | H-O | C-H |
E/��kJ��mol-1�� | 436 | 343 | 1076 | 465 | 413 |
�ɴ˼����H2=______________��
��2����Ӧi��ii��iii��Ӧ��ƽ�ⳣ��K1��K2��K3֮��Ĺ�ϵʽΪ_______________
��3��һ�������£���2L�ĺ����ܱ������г���1molCO2��2molH2������Ӧi ����ͼ�Ƿ�Ӧ��ϵ��CO2��ƽ��ת�������¶ȵĹ�ϵ���ߡ�

�١�H1_____0������ڡ���С�ڡ���
�ڵ��¶�Ϊ500Kʱ���÷�Ӧ10min�ﵽƽ�⡣0��10minʱ������CH3OH��ʾ�÷�
Ӧ�Ļ�ѧ��Ӧ����Ϊ_____________________��
�����ij���1mol CO2��3mol H2����ͼ�е�����_________������ơ������ơ�����
��4����3 L�ݻ��ɱ���ܱ������з�����Ӧiii����֪c(CO)�뷴Ӧʱ��t�仯���ߢ���ͼ��ʾ������t0ʱ�̷ֱ�ı�һ�����������ߢ��Ϊ���ߢ�����ߢ����ߢ��Ϊ���ߢ�ʱ���ı��������______�������ߢ��Ϊ���ߢ�ʱ���ı��������_______��

��5���Լ״�Ϊȼ�ϣ�����Ϊ��������KOH��ҺΪ�������Һ�����Ƴ�ȼ�ϵ�ء��Դ˵������Դ����ʵ������ģ������Ʒ���桰�ۻ����������̣�װ����ͼ��ʾ������������b��__________�� �����缫��ӦΪ_______________��

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com