
【题目】NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A. 等物质的量的N2和CO所含分子数均为NA
B. 常温下,0.1molCuSO4·5H2O晶体中氧原子数目为0.4 NA
C. NA个N2分子所占的体积与0.5NA个H2分子所占的体积比为2∶1
D. 常温下,1L 0.1mol·L-1的NH4NO3溶液中氮原子数为0.2NA
【答案】D
【解析】
1mol任何粒子中的粒子数称为阿伏加德罗常数,符号NA,单位mol-1。
A.题目中“等物质的量的N2和CO”,其物质的量未必是1mol,故所含的分子数未必是NA,A项错误;
B.每个“CuSO4·5H2O”中含有4+5×1=9个氧原子,则0.1molCuSO4·5H2O晶体中氧原子物质的量=0.1mol×9=0.9mol,即氧原子数目为0.9 NA,B项错误;
C.一定量的任何气体体积决定于温度和压强,本选项未明确N2和H2所处的温度和压强是否相同,所以无法计算它们的体积比,C项错误;
D.根据![]() =V(aq)·CB,1L 0.1mol·L-1的NH4NO3溶液中NH4NO3的物质的量=1L×0.1mol/L=0.1mol,每个“NH4NO3”含有2个氮原子,所以0.1molNH4NO3中含有0.2mol氮原子,即氮原子数为0.2NA,D项正确;答案选D。
=V(aq)·CB,1L 0.1mol·L-1的NH4NO3溶液中NH4NO3的物质的量=1L×0.1mol/L=0.1mol,每个“NH4NO3”含有2个氮原子,所以0.1molNH4NO3中含有0.2mol氮原子,即氮原子数为0.2NA,D项正确;答案选D。


科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的ΔH前者大于后者的是( )
①C(s)+O2(g)===CO2(g) ΔH1 C(s)+1/2O2(g)===CO(g) ΔH2
②S(s)+O2(g)===SO2(g) ΔH3 S(g)+O2(g)===SO2(g) ΔH4
③H2(g)+1/2O2(g)===H2O(l) ΔH5 2H2(g)+O2(g)===2H2O(l) ΔH6
④CaCO3(s)===CaO(s)+CO2(g) ΔH7 CaO(s)+H2O(l)===Ca(OH)2(s) ΔH8
A.① B.④ C.②③④ D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,电源A是氢氧燃料电池(电解质溶液为KOH溶液),B为浸透饱和氯化钠溶液的pH试纸,甲为电解池。请填空:
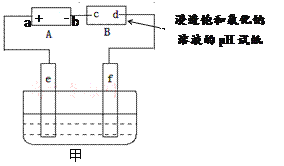
(1)电源A中a极应通入的气体是______,b极上发生的电极反应是_______________。
(2)通电后,试纸上c极称为_____极,实验中发现该极周围pH试纸变蓝色,原因是_____(结合电极反应式说明)。
(3)实验中d极周围可能观察到的现象是的______________________________。
(4)①若利用甲实现铁上镀锌,应将铁接_________极(填“e”或“f”);
②若利用甲实现粗铜的精炼,f电极上的反应是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池(MPC)处理技术是通过微生物的作用去除污染物,该技术可广泛应用于去除土壤中有机污染物。一种土壤微生物燃料电池的纵截面如图所示,下列说法不正确的是
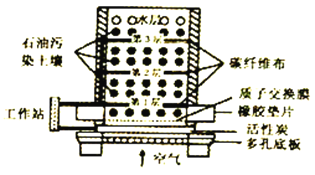
A. 电流从活性炭电极经工作站流向碳纤维布电极
B. 有机污染物在电池负极上氧化为对环境无害的物质
C. 活性炭能有效吸附空气,提高电池的工作效率
D. 该电池的正极反应式为O2+4e-↓+2H2O==4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三种短周期元素组成的单质a、b、c及其二元化合物X、Y、Z,它们之间相互转化关系如图所示。已知:X中a和b元素的原子个数比为1:1;常温下L是一种无色黏稠油状液体。下列说法不正确的是
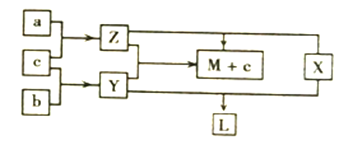
A. b、c单质中所含的元素属于同主族元素 B. X、Y、Z分子中一定都含有极性共价键
C. L、Y、Z三种物质中两两之间能相互反应 D. 同温同浓度的水溶液中酸性强弱为:L>Y>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R为前四周期原子序数依次增大的元素。X原子有3个能级,且每个能级上的电子数相等;Z原子的不成对电子数在同周期中最多,且Z的气态氢化物在同主族元素的氢化物中沸点最低;X、Y、R三元素在周期表中同族。
(1)R元素在周期表中的位置是_____________,其基态原子的电子排布式为[Ar]_______。
(2)如图表示X、Y、Z的四级电离能变化趋势,其中表示Z的曲线是_______(填标号)。
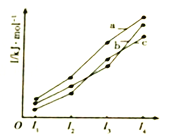
(3)化合物(XH2=X=O)分子中X原子杂化轨道类型是____________,1mol(X2H5O)3Z=O分子中含有的σ键与π键的数目比为__________________。
(4)Z与氯气反应可生成一种各原子均满足8电子稳定结构的化合物,其分子的空间构型为_____。
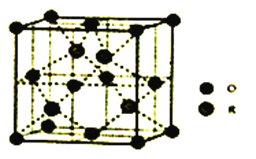
(5)某R的氧化物晶胞结构如图所示。该物质的化学式为_______________。已知该晶体密度为pg·cm-3,距离最近的两个原子的距离为dpm,则R的相对原子质量计算表达式为___________________________(已知lpm=10-12m,阿伏加德罗常数为NA)。
(6)X形成的一种常见单质,性质硬而脆,原因是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与金属腐蚀有关的说法正确的是( )
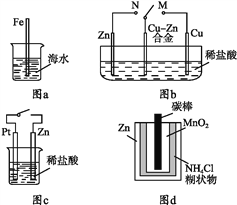
A. 图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B. 图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C. 图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D. 图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 化学变化过程是原子的重新组合过程
B. 化学反应的焓变用ΔH表示,单位是kJ·mol-1
C. 化学反应的焓变ΔH越大,表示放热越多
D. 化学反应中的能量变化不都是以热能形式表现出来的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知G、Q、X、Y、Z均为含氯元素的化合物,在一定条件下有下列转化关系(未配平):
①G―→Q+NaCl ②Q+H2O![]() X+H2
X+H2
③Y+NaOH―→G+Q+H2O
④Z+NaOH―→Q+X+H2O
这五种化合物中Cl元素化合价由低到高的顺序是( )
A. G、Y、Q、Z、X B. X、Z、Q、G、Y
C. X、Z、Q、Y、G D. G、Q、Y、Z、X
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com