
����Ŀ��X��Y��Z��RΪǰ������ԭ���������������Ԫ�ء�Xԭ����3���ܼ�����ÿ���ܼ��ϵĵ�������ȣ�Zԭ�ӵIJ��ɶԵ�������ͬ��������࣬��Z����̬�⻯����ͬ����Ԫ�ص��⻯���зе���ͣ�X��Y��R��Ԫ�������ڱ���ͬ�塣
��1��RԪ�������ڱ��е�λ����_____________�����̬ԭ�ӵĵ����Ų�ʽΪ[Ar]_______��
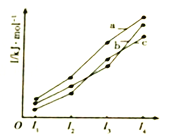
��2����ͼ��ʾX��Y��Z���ļ������ܱ仯���ƣ����б�ʾZ��������_______(����)��
��3��������(XH2=X=O)������Xԭ���ӻ����������____________��1mol(X2H5O)3Z=O�����к��е���������������Ŀ��Ϊ__________________��
��4��Z��������Ӧ������һ�ָ�ԭ�Ӿ�����8�����ȶ��ṹ�Ļ��������ӵĿռ乹��Ϊ_____��
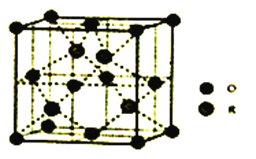
��5��ijR�������ᄃ���ṹ��ͼ��ʾ�������ʵĻ�ѧʽΪ_______________����֪�þ����ܶ�Ϊpg��cm-3���������������ԭ�ӵľ���Ϊdpm����R�����ԭ�������������ʽΪ___________________________(��֪lpm=10-12m�������ӵ�����ΪNA)��
��6��X�γɵ�һ�ֳ������ʣ�����Ӳ���࣬ԭ����_______________________��
���𰸡� ����������A�� 3d104s24p2 b sp��sp2 25:1 �����λ������� GeO��Ge4O4 ![]() ̼̼�����ܴ����ۼ��з����ԣ�����������ԭ�ӽṹ��λ�����ѣ���Ӳ���ࡣ
̼̼�����ܴ����ۼ��з����ԣ�����������ԭ�ӽṹ��λ�����ѣ���Ӳ���ࡣ
�����������������Xԭ����3���ܼ�����ÿ���ܼ��ϵĵ�������ȣ�X��CԪ�أ�Zԭ�ӵIJ��ɶԵ�������ͬ��������࣬��Z����̬�⻯����ͬ����Ԫ�ص��⻯���зе���ͣ�Z��PԪ�أ�X��Y��R��Ԫ�������ڱ���ͬ�壬 Y��R�ֱ���Si��Ge��
��������1��R��GeԪ�أ������ڱ��е�λ���ǵ���������A�壬Ge������32�����������̬ԭ�ӵĵ����Ų�ʽΪ[Ar] 3d104s24p2����2��Pԭ�Ӽ۵����Ų���3s23p3���ĵ����ܱȵ�������������������������ʾP��������b����3�������� �����Тٺ�Cԭ����3��
�����Тٺ�Cԭ����3��![]() �� ���¶Ե��ӣ������ӻ����������sp2���ں�Cԭ����2��
�� ���¶Ե��ӣ������ӻ����������sp2���ں�Cԭ����2��![]() ���¶Ե��ӣ������ӻ����������sp��������
���¶Ե��ӣ������ӻ����������sp��������![]() ����˫����1��
����˫����1��![]() ����1��
����1��![]() ����1mol(C2H5O)3P=O�����к��е���������������Ŀ��Ϊ25:1����4��P��������Ӧ������һ�ָ�ԭ�Ӿ�����8�����ȶ��ṹ�Ļ�����û�������PCl3��Pԭ�Ӽ۵��Ӷ�����4����1�Թ¶Ե��ӣ���������ӵĿռ乹��Ϊ����������5�����ݾ�̯ԭ����һ����������Geԭ����4������Oԭ������
����1mol(C2H5O)3P=O�����к��е���������������Ŀ��Ϊ25:1����4��P��������Ӧ������һ�ָ�ԭ�Ӿ�����8�����ȶ��ṹ�Ļ�����û�������PCl3��Pԭ�Ӽ۵��Ӷ�����4����1�Թ¶Ե��ӣ���������ӵĿռ乹��Ϊ����������5�����ݾ�̯ԭ����һ����������Geԭ����4������Oԭ������![]() �������ʵĻ�ѧʽΪGeO���������������ԭ�ӵľ���Ϊdpm����߳���
�������ʵĻ�ѧʽΪGeO���������������ԭ�ӵľ���Ϊdpm����߳���![]() ����Ge�����ԭ������Ϊx��
����Ge�����ԭ������Ϊx��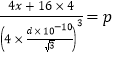 ��x=
��x=![]() ����6��̼̼�����ܴ����ۼ��з����ԣ�����������ԭ�ӽṹ��λ�����ѣ���Ӳ���ࡣ
����6��̼̼�����ܴ����ۼ��з����ԣ�����������ԭ�ӽṹ��λ�����ѣ���Ӳ���ࡣ


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ȼ�ѧ����ʽ��д��ȷ����
A. ��֪�����ȼ����Ϊ890.3 kJmol-1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��CH4(g)��2O2(g)��CO2(g)��2H2O(g) ��H����890.3 kJmol-1
B. ��֪ǿ���ǿ���ϡ��Һ��Ӧ���к���Ϊ57.3 kJmol-1����CH3COOH��OH����CH3COO����H2O ��H����57.3 kJmol-1
C. һ�������£���0.5mol N2��1.5mol H2�����ܱ������У���ַ�Ӧ����NH3(g)���ų�����19.3kJ�����Ȼ�ѧ����ʽΪ��N2(g)��3H2(g)![]() 2NH3(g) ��H����38.6 kJmol-1
2NH3(g) ��H����38.6 kJmol-1
D. ��֪1g N2H4(l)������H2O2(l)��Ӧ���ɵ�����ˮ�������ų�����20.05kJ�����Ȼ�ѧ����ʽ�ɱ�ʾΪ��N2H4(l)��2H2O2(l)��N2(g)��4H2O(g) ��H����641.6 kJmol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�֪ʶ�ش���������
��1��25��ʱ��0.1 molL��1��һԪ��HA��Һ��c(H��)��1.0��10��4 molL��1����ش��������⣺��ʱ��Һ��pH��_______��HA��________�ᣨ�ǿ������������
��2������NaHCO3��NaHSO3��NaHSO4���ֳ�������ʽ�Σ������ڹ�ҵ�������ճ����������Ź㷺��Ӧ�á���ش��й����⣺
��25��ʱ��NaHCO3��ˮ��Һ��_____�ԣ���ᡱ�����
��25��ʱ�����ʵ���Ũ�Ⱦ�Ϊ0.01 molL��1��������ʽ����Һ��pH��С��_________��
��3����50ml 0.018molL��1��AgNO3��Һ�м���50m1 0.020molL��1����������AgCl��������֪���¶���Ksp(AgCl)��1.0��10��10��������Һ������仯����ȫ��������Һ��c(Ag+)��__molL��1��
��4��������KMnO4��Һ�ζ������ʵ�Na2C2O4��Ʒ�����ʲ����뷴Ӧ����
ʵ�鲽�裺ȷ��ȡ1g Na2C2O4������Ʒ�����Ƴ�100mL��Һ��ȡ��20.00mL����ƿ�С�������ƿ�м�������ϡH2SO4��Һ����0.016 molL��1���������Һ�ζ����ζ����յ�ʱ���ĸ��������Һ25.00mL��
����֪��5H2C2O4��2KMnO4��3H2SO4��10CO2����2MnSO4��K2SO4��8H2O��
�ٸ��������ҺӦװ��_______�ζ����У������ʽ����ʽ������
�ڵζ����յ�ʱ��ʵ�������ǣ�__________________________________________��
�����в�������ʹ�������ƫ�ߵ���__________��
A��ʢװ��Na2C2O4�ĵζ���û��ϴ
B��ʢװ���������Һ�ĵζ��ܵζ�ǰ���촦�����ݣ��ζ���������ʧ
C������ʱ�ζ�ǰ���ӣ��ζ�����
D����ƿ�в�������ˮ
�ܼ�����Ʒ��Na2C2O4�Ĵ���______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͨ�����з�ɢϵʱ���ܹ۲쵽�����ЧӦ����( )
A.�ཬB.CuSO4��ҺC.Fe(OH)3����D.�ƾ���Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA��ʾ�����ӵ�������ֵ������������ȷ���ǣ� ��
A. �����ʵ�����N2��CO������������ΪNA
B. �����£�0.1molCuSO4��5H2O��������ԭ����ĿΪ0.4 NA
C. NA��N2������ռ�������0.5NA��H2������ռ�������Ϊ2��1
D. �����£�1L 0.1mol��L-1��NH4NO3��Һ�е�ԭ����Ϊ0.2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ŀ����ҵ�ϳ��л���F��·������:
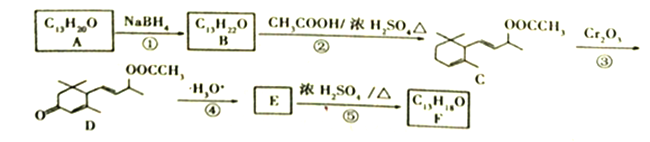
��֪:��![]() ��
��
��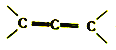 �ṹ���ȶ������ӿ��ǡ�
�ṹ���ȶ������ӿ��ǡ�
��1��A�к��������ŵ�����Ϊ_______________��C��D��Ӧ�۵�����Ϊ_____________��
��2��������B�Ľṹ��ʽΪ__________��F��Br2�����ʵ���֮��1:1�ӳ����ò�����____�֡�
��3��E��F�Ļ�ѧ����ʽΪ___________________________��
��4������ת����ϵ�У���Ʋ���ںܵ͢�Ŀ����______________________________________��
��5��H��A��ͬ���칹�壬��дһ����������������H�Ľṹ��ʽ________________��
����FeCl3��Һ������ɫ��Ӧ��
�ں˴Ź���������5��壬�ҷ����֮��Ϊ1:2:2:3:12��
��6�����������ϳ�·�ߣ���Ʋ�д����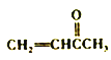 �ϳɾ�1.3-����ϩ��·������ͼ(���Լ���ѡ)�� ______________________________
�ϳɾ�1.3-����ϩ��·������ͼ(���Լ���ѡ)�� ______________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����c(CH3COOH)+c(CH3COO-)=0.1mol��L-1��һ����ᡢ�����ƻ����Һ����Һ��c(CH3COOH)��c(CH3COO-)������ռ���ʵ�������(a)����ҺpH�仯�Ĺ�ϵ��ͼ��ʾ������˵���������
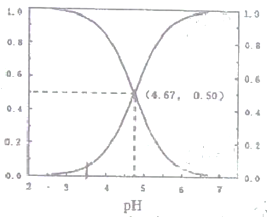
A. pH��4.67����Һ�У�c(CH3COO-)��c(CH3COOH)
B. pH=7����Һ�У�c(CH3COOH)=0��c(CH3COO-)=1.0
C. ��pH=4.67����Һ�У�c(Na+)+c(H+)=c(CH3COOH)+c(0H-)
D. pH=3.5����Һ�У�c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1mol��L-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������NaCl��FeCl2��FeCl3��MgCl2��AlCl3������Һ��ֻ��һ���Լ��Ϳ��Լ������ǣ������Լ��ǣ�������
A.����
B.NaOH��Һ
C.��ˮ
D.KSCN��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ֽ���Ԫ����ɵĺϽ�10.5g��Ͷ��������ϡ�����з�Ӧ��ȫ�����������1g������ɸúϽ��Ԫ�ؿ�����
A. Fe��Zn B. Mg��Cu C. Na��Mg D. Al��Fe
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com