
【题目】现有由两种金属元素组成的合金10.5g,投入足量的稀硫酸中反应完全后,测得生成氢气1g,则组成该合金的元素可能是
A. Fe与Zn B. Mg与Cu C. Na与Mg D. Al与Fe
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R为前四周期原子序数依次增大的元素。X原子有3个能级,且每个能级上的电子数相等;Z原子的不成对电子数在同周期中最多,且Z的气态氢化物在同主族元素的氢化物中沸点最低;X、Y、R三元素在周期表中同族。
(1)R元素在周期表中的位置是_____________,其基态原子的电子排布式为[Ar]_______。
(2)如图表示X、Y、Z的四级电离能变化趋势,其中表示Z的曲线是_______(填标号)。
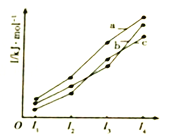
(3)化合物(XH2=X=O)分子中X原子杂化轨道类型是____________,1mol(X2H5O)3Z=O分子中含有的σ键与π键的数目比为__________________。
(4)Z与氯气反应可生成一种各原子均满足8电子稳定结构的化合物,其分子的空间构型为_____。
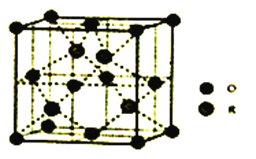
(5)某R的氧化物晶胞结构如图所示。该物质的化学式为_______________。已知该晶体密度为pg·cm-3,距离最近的两个原子的距离为dpm,则R的相对原子质量计算表达式为___________________________(已知lpm=10-12m,阿伏加德罗常数为NA)。
(6)X形成的一种常见单质,性质硬而脆,原因是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组设计了如下从海带灼烧后的海带灰中提取碘单质的流程:
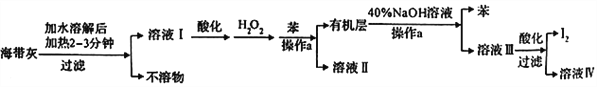
(1)溶解海带灰时要加热煮沸2~3min的目的是_________,操作a的名称是 _______。
(2)向酸化的溶液I中加入H2O2的目的是__________________________________。
(3)已知I2与40%的NaOH溶液反应生成的氧化产物和还原产物的物质的量之比为1:5,则发生反应的化学方程式是________________________________。
(4)最后过滤得到的I2需要进行洗涤和干燥,下列洗涤剂中最应该选用的是______。
a.热水 b.乙醇 c.冷水 d.二硫化碳
(5)用Na2S2O3的标准溶液测定产品的纯度,发生反应:I2+2Na2S2O3=Na2S4O6+2NaI。取5.0g产品,配制成100ml溶液。取10.00ml溶液,以淀粉溶液为指示剂,用浓度为0.050mol·L-1Na2S2O3的标准溶液进行滴定,相关数据记录如下表所示。
编号 | 1 | 2 | 3 |
溶液的体积/mL | 10.00 | 10.00 | 10.00 |
消耗Na2S2O3标准溶液的体积/mL | 19.95 | 17.10 | 20.05 |
滴定时,达到滴定终点的现象是________,碘单质在产品中的质量分数是________% 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知G、Q、X、Y、Z均为含氯元素的化合物,在一定条件下有下列转化关系(未配平):
①G―→Q+NaCl ②Q+H2O![]() X+H2
X+H2
③Y+NaOH―→G+Q+H2O
④Z+NaOH―→Q+X+H2O
这五种化合物中Cl元素化合价由低到高的顺序是( )
A. G、Y、Q、Z、X B. X、Z、Q、G、Y
C. X、Z、Q、Y、G D. G、Q、Y、Z、X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2) 作为一种高效强氧化剂,已被联合国世界卫生组织(WHO)列为AI级安全消毒剂。某研究小组设计如图所示装置制备ClO2和NaClO2。已知: ClO2熔点一59℃、沸点11℃,常温下ClO2为黄绿色或橘黄色气体,ClO2浓度过高或受热易分解,甚至会爆炸。NaClO2 高于60℃时分解生成NaClO3和NaCl。

(1)装置连接好后,加入药品前需进行的操作是____________________________________。
(2)使用恒压分液漏斗的目的是_________________;仪器B 的作用是_________________。
(3)A 中反应为2NaClO3+H2O2+H2SO4=2C1O2↑+O2↑+Na2SO4+2H2O。
C 中反应的化学方程式是_______________, 冷水浴的目的是_________________________。
(4) 实验中持续通入空气能稀释生成的ClO2并将其排到C处。若空气的流速太慢可能造成的后果是_______________________________________。
(5)已知: ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH 的关系如图所示。当pH≤2.0 时,ClO2-也能被I- 完全还原为Cl-。反应生成的I2与Na2S2O3 反应的方程式: 2Na2S2O3+ I2= Na2S4O6 + 2NaI。
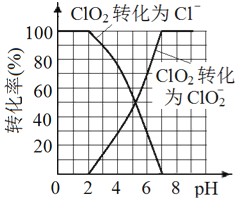
用ClO2消毒的饮用水中含有ClO2、ClO2-。测定饮用水中ClO2、ClO2-的含量,分两步进行:
①用紫外分光光度法测得水样中ClO2的含量为amol/L。
②用滴定法测量ClO2-的含量。请完成相应的实验步骤:
步骤1: 准确量取VmL 上述水样加入锥形瓶中。
步骤2: 调节水样的pH________。
步骤3: 加入足量的KI 晶体,充分反应。
步骤4: 加入少量淀粉溶液,用cmol/L Na2S2O3 溶液滴定至终点,消耗Na2S2O3 溶液V1mL。
根据上述分析数据,测得该饮用水中ClO2-的浓度为____mol/L( 用含字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中蕴藏着丰富的资源,在实验室中取少量海水,进行如下流程的实验:
![]()
![]()
![]() ―→
―→![]() ―→
―→![]()
粗盐中含Ca2+、Mg2+、Fe3+、SO![]() 等杂质,提纯的步骤有:
等杂质,提纯的步骤有:
①加入过量的Na2CO3溶液 ②加入过量的BaCl2溶液 ③加入过量的NaOH溶液 ④加入适量盐酸 ⑤溶解 ⑥过滤 ⑦蒸发,其正确的操作顺序是( )
A. ⑤②③①⑥④⑦ B. ⑤①②③⑥④⑦
C. ⑤②①③④⑥⑦ D. ⑤③①②⑥④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,取一定量的PbI2固体配成饱和溶液,T时刻改变某一条件,离子浓度变化如图所示,下列有关说法正确的是( )

A.常温下,PbI2的Ksp为2×10-6
B.温度不变,向PbI2饱和溶液中加入少量硝酸铅浓溶液,PbI2的溶解度不变,Pb2+浓度不变
C.T时刻改变的条件是升高温度,因而PbI2的Ksp增大
D.常温下Ksp(PbS)=8×10-28,向PbI2的悬浊液中加入Na2S溶液, PbI2(s)+S2-(aq)![]() PbS(s)+2I-(aq)反应的化学平衡常数为5×1018
PbS(s)+2I-(aq)反应的化学平衡常数为5×1018
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com