
【题目】如图,电源A是氢氧燃料电池(电解质溶液为KOH溶液),B为浸透饱和氯化钠溶液的pH试纸,甲为电解池。请填空:
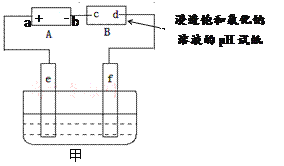
(1)电源A中a极应通入的气体是______,b极上发生的电极反应是_______________。
(2)通电后,试纸上c极称为_____极,实验中发现该极周围pH试纸变蓝色,原因是_____(结合电极反应式说明)。
(3)实验中d极周围可能观察到的现象是的______________________________。
(4)①若利用甲实现铁上镀锌,应将铁接_________极(填“e”或“f”);
②若利用甲实现粗铜的精炼,f电极上的反应是_____________________________。
【答案】 O2 H2-2e-+2OH-=2H2O 阴 发生反应2H2O+2e-=H2+2OH-,该电极周围溶液呈碱性 电极周围先变红,后由电极中心向外慢慢褪色 f Cu2++2e-=Cu
【解析】本题主要考查原电池和电解池原理。
(1)电源A中a极作正极,发生还原反应,应通入的气体是氧气,b极上发生的电极反应是H2-2e-+2OH-=2H2O。
(2)通电后,试纸上c极与负极相连,称为阴极,实验中发现该极周围pH试纸变蓝色,原因是:发生反应2H2O+2e-=H2+2OH-,该电极周围溶液呈碱性。
(3)实验中d极产生氯气,氯气遇水产生盐酸和次氯酸,pH试纸先在盐酸作用下变红,后在次氯酸作用下被漂白而褪色,所以d极周围可能观察到的现象是:电极周围先变红,后在次氯酸由电极中心向外慢慢褪色。
(4)①若利用甲实现铁上镀锌,应将铁接阴极f极;
②若利用甲实现粗铜的精炼,f电极上发生还原反应,反应是Cu2++2e-=Cu。


科目:高中化学 来源: 题型:
【题目】关于下列四个图象的说法中不正确的是
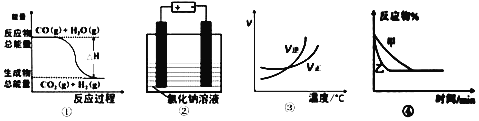
A. 图①可表示可逆反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0
CO2(g)+H2(g) ΔH<0
B. 图②表示用惰性电极电解足量氯化钠溶液时,两极产生的气体物质的量相等
C. 图③可表示可逆反应:A2(g)+3B2(g)![]() 2AB3(g) ΔH >0
2AB3(g) ΔH >0
D. 图④可表示压强对可逆反应:2A(g)+B(g)![]() 3C(g)+D(s)的影响,且乙压强大
3C(g)+D(s)的影响,且乙压强大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂-空气电池是一种新型的二次电池,由于具有较高的比能量而成为未来电动汽车的希望。其放电时的工作原理如图所示。下列说法正确的是
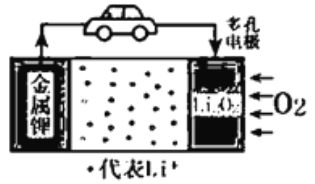
A. 该电池放电时,锂电极发生了还原反应
B. 放电时,Li+向锂电极迁移
C. 电池中的电解液可以是有机电解液或稀盐酸等
D. 充电时,电池正极的反应式为Li2O2-2e-=2Li++O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验是进行化学研究的有效方法,请回答下列实验中的有关问题。
I.用如图所示的装置测定中和热。

实验药品:100mL 0.50 molL-1盐酸、100mL 0.55 molL-1NaOH溶液。
实验步骤:略。
回答下列问题:
(1)从实验装置上看,还缺少环形玻璃搅拌棒,该装置的作用是____________;有同学提议可以用铜质搅拌棒替代,你是否赞同(说明理由)________________。
(2)你认为该实验成功的关键是______________________________。
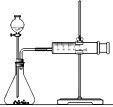
II.影响化学反应速率的因素很多,某校课外兴趣小组用实验的方法进行探究。甲、乙两个兴趣小组利用Mg、Fe、Cu和不同浓度的硫酸(0.5 molL-1、2 molL-1、18.4 molL-1),设计实验方案来研究影响反应速率的因素。
(1)请帮助甲小组完成研究的实验报告:
实 验 步 骤 | 现 象 | 结 论 |
①分别取等体积0.5 molL-1硫酸于试管中 ②分别投入大小、形状相同的Mg、Fe、Cu ③观察金属表面产生气体的快慢 | ①产生气体的速率Mg>Fe ②Cu上无气体产生 | _________ |
根据控制变量法,要得出正确的实验结论,在实验过程中需要保持温度和压强相同。
(2)乙小组为了更精确地研究浓度对反应速率的影响,利用右图装置进行定量实验。该小组选用的实验药品是:Fe、2molL-1硫酸和______molL-1硫酸。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据有关知识回答下列问题
(1)25℃时,0.1 molL-1的一元酸HA溶液中c(H+)=1.0×10-4 molL-1,请回答下列问题:此时溶液的pH=_______,HA是________酸(填“强”或“弱”)。
(2)现有NaHCO3、NaHSO3、NaHSO4三种常见的酸式盐,它们在工业生产和日常生活中有着广泛的应用。请回答有关问题:
①25℃时,NaHCO3的水溶液显_____性(填“酸”或“碱”)。
②25℃时,物质的量浓度均为0.01 molL-1的三种酸式盐溶液,pH最小是_________。
(3)向50ml 0.018molL-1的AgNO3溶液中加入50m1 0.020molL-1的盐酸生成AgCl沉淀。已知该温度下Ksp(AgCl)=1.0×10﹣10,忽略溶液的体积变化,完全沉淀后,溶液中c(Ag+)=__molL-1。
(4)用酸性KMnO4溶液滴定含杂质的Na2C2O4样品(杂质不参与反应)。
实验步骤:准确称取1g Na2C2O4固体样品,配制成100mL溶液,取出20.00mL于锥形瓶中。再向锥形瓶中加入足量稀H2SO4溶液,用0.016 molL-1高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液25.00mL。
(已知:5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O)
①高锰酸钾溶液应装在_______滴定管中.(填“酸式”或“碱式”)。
②滴定至终点时的实验现象是:__________________________________________。
③下列操作可能使测量结果偏高的是__________。
A.盛装的Na2C2O4的滴定管没润洗
B.盛装高锰酸钾溶液的滴定管滴定前尖嘴处有气泡,滴定后气泡消失
C.读数时滴定前仰视,滴定后俯视
D.锥形瓶中残留少量水
④计算样品中Na2C2O4的纯度______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物F是一种临床常用的基本药物,有广泛的用途,其合成路线如下:
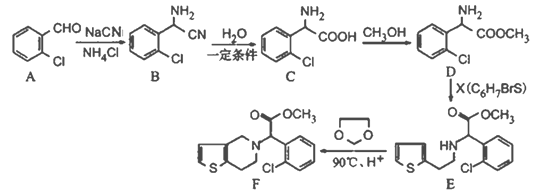
(1)写出B的分子式________________;C中碱性官能团的名称为____________________。
(2)写出与A含有相同官能团,属于芳香族化合物;且含有3种不同化学环境氢原子的同分异构体的结构简式__________________________________。
(3)C→D的反应类型是______________;X的结构简式为______________________。
(4)两个C分子可在一定条件下反应生成一种产物,该产物分子中含有3个六元环,写出该反应的化学方程式____________________________________。
(5)已知: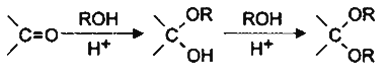
I.则由乙醇、甲醇为有机原料制备化合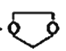 物,不需要经历下列的反应类型有____(填写编号)。
物,不需要经历下列的反应类型有____(填写编号)。
①加成反应,②消去反应,③取代反应,④氧化反应,⑤还原反应。
II.写出制备化合物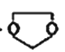 的最后一步反应的化学方程式________________________。
的最后一步反应的化学方程式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A. 等物质的量的N2和CO所含分子数均为NA
B. 常温下,0.1molCuSO4·5H2O晶体中氧原子数目为0.4 NA
C. NA个N2分子所占的体积与0.5NA个H2分子所占的体积比为2∶1
D. 常温下,1L 0.1mol·L-1的NH4NO3溶液中氮原子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】控制适当的条件,将反应2Fe3++2I-![]() 2Fe2++I2设计成如图所示的原电池,下列判断错误的是
2Fe2++I2设计成如图所示的原电池,下列判断错误的是
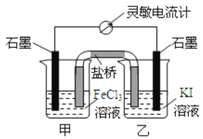
A. 反应开始时,乙中电极反应为2I--2e-=I2
B. 反应开始时,甲中石墨电极上发生还原反应
C. 电流计读数为零时,反应达到化学平衡状态
D. 平衡时乙中溶入碘后,甲池的石墨电极为正极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com