
【题目】氮是一种重要的元素,可用来合成NH3与 HNO3等一系列重要化工产品。
(1)在标准状况下,1体积水溶解700体积氨气,所得溶液的密度为0.9g/mL,则该氨水的物质的量浓度是_______(小数点后保留一位)。
(2)合成氨的原料气N2和H2通常是以焦炭、水和空气为原料来制取的。其主要反应是:
①2C + O2 → 2CO ②C + H2O(g) → CO + H2 ③CO + H2O(g) → CO2 + H2
某次生产中将焦炭、H2O(g)和空气(设空气中N2和O2的体积比为4:1,下同)混合反应,所得气体产物经分析,组成如下表:
气体 | CO | N2 | CO2 | H2 | O2 |
体积(m3)(标准状况) | x | 20 | 12 | 60 | 1.0 |
则计算参加反应的H2O(g)和氧气的体积比V(H2O)/V(氧气)=__________上表中x=________m3,实际消耗了___________ kg焦炭。
(3)工业生产硝酸时尾气必须充分处理以避免环境污染,常用NaOH溶液吸收,吸收时发生反应:
①2NO2 + 2NaOH→NaNO3 + NaNO2 + H2O
②NO + NO2 + 2NaOH→2NaNO2 + H2O
现将22.4升(标准状况)NOx(只含NO、NO2,忽略其它成分)气体缓缓通入足量NaOH溶液中,充分反应,气体全部被吸收。则反应中产生NaNO3和NaNO2各多少克?(用含x的代数式表示)____________________
【答案】18.4 mol/L 15 44 30 85(x-1.5);69(2.5-x)
【解析】
(1)由标准状况下的体积可计算氨气的物质的量,利用氨气的质量和溶液的体积来计算物质的量浓度;
(2)N2的体积为20m3,空气中N2和O2的体积比为4:1,故O2的体积为5m3,故参加反应的O2的体积为5m3-1.0m3=4m3,根据方程式,结合表格数据进行计算,得出正确结论;
(3)NOx气体的物质的量为![]() =1mol,NO、NO2的平均组成为NOx,则NO与NO2的物质的量之比为
=1mol,NO、NO2的平均组成为NOx,则NO与NO2的物质的量之比为![]() ,设NO为amol,则NO2为(1-a)mol,则
,设NO为amol,则NO2为(1-a)mol,则![]() =
=![]() ,解得a=2-x,1-a=x-1,
,解得a=2-x,1-a=x-1,
根据方程式进行计算,得出正确结论。
(1)设水的体积为1L,氨气的体积为700L,则氨气的物质的量为![]() =31.25mol,
=31.25mol,
溶液的质量为1000g+31.25mol×17g/mol=1531.25g,
溶液的体积为![]() =1.7L,
=1.7L,
则氨水的物质的量浓度为c=![]() =18.4 mol/L;
=18.4 mol/L;
(2)N2的体积为20m3,空气中N2和O2的体积比为4:1,故O2的体积为![]() =5m3,故参加反应的O2的体积为5-1.0m3=4m3,
=5m3,故参加反应的O2的体积为5-1.0m3=4m3,
①2C+O2→2CO ②C+H2O(g)→CO+H2 ③CO+H2O(g)→CO2+H2
4 8 48 48 12 12 12
生成氢气的体积为12m3,故消耗的水的体积为60m3,则参加反应的H2O(g)和氧气的体积比V(H2O)/V(氧气)=![]() =15;
=15;
产物中二氧化碳的体积为12m3,故反应③生成氢气的体积为12m3,消耗CO的体积为12m3,
则反应②生成氢气的体积为60-12=48m3,故反应②生成CO的体积为48m3,消耗的C的物质的量为![]() ;
;
参加反应的O2的体积为4m3,故反应①生成CO的体积为8m3,消耗的C的物质的量为![]() ;
;
则所得气体产物中CO的体积为8m3+48m3-12m3=44m3,消耗的C的质量为=![]() ×12=30000g=30kg;
×12=30000g=30kg;
(3)NOx气体的物质的量为![]() =1mol,NO、NO2的平均组成为NOx,则NO与NO2的物质的量之比为
=1mol,NO、NO2的平均组成为NOx,则NO与NO2的物质的量之比为![]() ,
,
设NO为amol,则NO2为(1-a)mol,则![]() =
=![]() ,解得a=2-x,1-a=x-1,
,解得a=2-x,1-a=x-1,
①2NO2+2NaOH→NaNO3 +NaNO2 +H2O ②NO+NO2 +2NaOH→2NaNO2+H2O
2x-3 (x-1.5)(x-1.5)2-x 2-x 4-2x
反应②中反应的NO2的物质的量为(2-x)mol,则反应②中反应的NO2的物质的量为(2-x)mol,生成的NaNO2的物质的量为2×(2-x)=(4-2x)mol,
则反应①中反应的NO2的物质的量为x-1-(2-x)=(2x-3)mol,则反应①中生成的NaNO2的物质的量为![]() =(x-1.5)mol,生成的NaNO3的物质的量为(x-1.5)mol,
=(x-1.5)mol,生成的NaNO3的物质的量为(x-1.5)mol,
故反应中产生NaNO3的质量为85×(x-1.5)=(85x-127.5)g,
产生NaNO2的质量为69×(4-2x+x-1.5)=(172.5-69x)g,
答:产生NaNO3和NaNO2分别为(85x-127.5)g、(172.5-69x)g。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某兴趣小组设计如下微型实验装置。实验时,现断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表指针偏转,下列有关描述正确的是
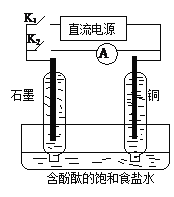
A. 断开K2,闭合K1时,总反应的离子方程式为:2H++2Cl—![]() Cl2↑+H2↑
Cl2↑+H2↑
B. 断开K2,闭合K1时,石墨电极附近溶液变红
C. 断开K1,闭合K2时,铜电极上的电极反应为:Cl2+2e—=2Cl—
D. 断开K1,闭合K2时,石墨电极作正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离过程为H2O![]() H++OH,在不同温度下其离子积为Kw(25℃)=1.0×1014,Kw(35℃)=2.1×1014,则下列叙述正确的是
H++OH,在不同温度下其离子积为Kw(25℃)=1.0×1014,Kw(35℃)=2.1×1014,则下列叙述正确的是
A.c(H+)随着温度的升高而降低
B.在35 ℃ 的纯水中时,c(H+)>c(OH)
C.水的电离常数Kw(25℃)>Kw(35℃)
D.水的电离是一个吸热过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图表示反应M (g) + N (g)![]() 2R(g)过程中能量变化,下列有关叙述正确的是
2R(g)过程中能量变化,下列有关叙述正确的是

A.由图可知,2molR的能量高于1molM和1molN的能量和
B.曲线B代表使用了催化剂,反应速率加快,M的转化率: 曲线B >曲线A
C.1molM和1molN的总键能高于2molR的总键能
D.对反应2R(g) ![]() M (g) + N (g)使用催化剂没有意义
M (g) + N (g)使用催化剂没有意义
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯氨是氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2Cl、NHCl2和NCl3),副产物少于其它水消毒剂。回答下列问题:
(1)①一氯胺(NH2Cl)的电子式为 ________________ 。
②工业上可利用反应Cl2(g)+NH3(g)=NH2Cl(g)+HCl(g)制备一氯胺,已知部分化学键的键能如下表所示(假设不同物质中同种化学键的键能相同),则该反应的△H=________。
化学键 | N-H | Cl-Cl | N-Cl | H-Cl |
键能(kJ/mol) | 391 | 243 | 191 | 431 |
③一氯胺是重要的水消毒剂,其原因是由于一氯胺在中性、酸性环境中会发生水解,生成具有强烈杀菌消毒作用的物质,该反应的化学方程式为_________________________________。
(2)用Cl2和NH3反应制备二氯胺的方程式为2Cl2(g)+NH3(g)![]() NHCl2(l)+2HCl(g),向容积均为1 L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2 mol Cl2和2 mol NH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
NHCl2(l)+2HCl(g),向容积均为1 L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2 mol Cl2和2 mol NH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(Cl2)(甲容器)/mol | 2.00 | 1.50 | 1. 10 | 0.80 | 0.80 |
n(Cl2) (乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①甲容器中,0~40 min内用NH3的浓度变化表示的平均反应速率v(NH3)=___________。
②该反应的△H________0(填“>”或“<”) 。
③对该反应,下列说法正确的是______________(填选项字母)。
A.若容器内气体密度不变,则表明反应达到平衡状态
B.若容器内Cl2和NH3物质的量之比不变,则表明反应达到平衡状态
C.反应达到平衡后,其他条件不变,在原容器中充入一定量氦气,Cl2的转化率增大
D.反应达到平衡后,其他条件不变,加入一定量的NHCl2,平衡向逆反应方向移动
(3)在恒温条件下,2molCl2和1molNH3发生反应2Cl2(g)+NH3(g)![]() NHCl2(l)+2HCl(g),测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示:
NHCl2(l)+2HCl(g),测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示:

①A、B、C三点中Cl2转化率最高的是______点(填“A”“B”或“C”)。(提示:C点时HCl和Cl2的浓度相等)
②计算C点时该反应的压强平衡常数Kp(C)=_________(Kp是平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1 mol CH4气体完全燃烧放出的热量为802 kJ,但当不完全燃烧生成CO和H2O时,放出的热量为519 kJ。如果1 mol CH4与一定量O2燃烧生成CO、CO2、H2O,并放出731.25 kJ的热量,则一定量O2的质量为( )
A. 40 g B. 56 g
C. 60 g D. 64 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值,以下说法正确的是
A.2NA个HCl分子与44.8 L H2和Cl2的混合气体所含的原子数目均为4NA。
B.32gCu将足量浓、稀硝酸分别还原为NO2和NO,浓、稀硝酸得到的电子数均为NA。
C.物质的量浓度均为1mol/L的NaCl和MgCl2混合溶液中,含有Cl―的数目为3NA。
D.1mol D318O+(其中D代表![]() )中含有的中子数为10 NA。
)中含有的中子数为10 NA。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质存在如图所示的转化关系,已知C、G、H为中学常见的单质,其中G 固态时呈紫黑色,C、H在通常状况下为气体,实验室常用E在B的催化加热下制单质H。
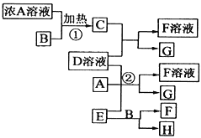
(1)写出B物质的名称 _______________________ ;
(2)写出①的化学反应方程式 ___________________________________________________ ;
(3)写出②的离子方程式_____________________________________________________________;
(4)在D溶液中通入C 后的溶液中,分离出G 的操作名称是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硅(Si3N4)是一种重要的陶瓷材料,可用石英与焦炭在1400~1450℃的氮气气氛下合成:3SiO2(s)+6C(s)+2N2(g)![]() Si3N4(s)+6CO(g)﹣Q(Q>0),在反应条件下,向10L密闭容器中加入反应物,10min后达到平衡。完成下列填空:
Si3N4(s)+6CO(g)﹣Q(Q>0),在反应条件下,向10L密闭容器中加入反应物,10min后达到平衡。完成下列填空:
(1)上述反应所涉及的元素,原子半径由大到小的顺序是______。其中一种元素的原子核外s电子数与p电子数相等,写出它的最外层电子排布的轨道表示式______。比较碳、硅两种元素的非金属性强弱,可以通过比较______(填:化合物性质的差异)来判断
(2)上述反应混合物中的极性分子是______,写出非极性分子的电子式______。从晶体类型的角度分析用氮化硅制造发动机中耐热部件的原因是______
(3)下列措施可以提高二氧化硅转化率的是______(选填编号)
a.增加二氧化硅用量b.升高反应温度
c.增大气体压强 d.向反应容器中多充入氮气
(4)下列描述中能说明反应已达平衡的是______(选填编号)
a.c(CO)=3c(N2)
b.v (CO)=3v(N2)
c.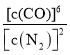 保持不变
保持不变
d.气体的压强保持不变
(5)测得平衡时固体质量减少了11.2g,则用氮气表示的平均反应速率为______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com