
【题目】水的电离过程为H2O![]() H++OH,在不同温度下其离子积为Kw(25℃)=1.0×1014,Kw(35℃)=2.1×1014,则下列叙述正确的是
H++OH,在不同温度下其离子积为Kw(25℃)=1.0×1014,Kw(35℃)=2.1×1014,则下列叙述正确的是
A.c(H+)随着温度的升高而降低
B.在35 ℃ 的纯水中时,c(H+)>c(OH)
C.水的电离常数Kw(25℃)>Kw(35℃)
D.水的电离是一个吸热过程
【答案】D
【解析】
A.水的电离为吸热的过程,升高温度,平衡正向移动;
B.纯水始终为中性;
C.Kw(25℃)=1.0×1014,Kw(35℃)=2.1×1014,根据具体数值进行比较;
D.水的电离是一个吸热过程。
A.水的电离为吸热的过程,升高温度,平衡正向移动,因此c(H+)随着温度的升高而增大,A项错误;
B.纯水始终为中性,即c(H+)=c(OH),因此在35 ℃ 的纯水中,c(H+)=c(OH),B项错误;
C.Kw(25℃)=1.0×1014,Kw(35℃)=2.1×1014,因此水的电离常数Kw(25℃)<Kw(35℃),C项错误;
D.水的电离是一个吸热过程,D项正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 弱酸酸式盐NaHB在水溶液中水解:HB–+H2O ![]() H3O++B2–
H3O++B2–
B. 硫化钠水解: S2- + 2H2O = H2S↑+2OH-
C. 碳酸钠溶液显碱性:CO32-+H2O ![]() HCO3-+OH-
HCO3-+OH-
D. 制备氢氧化铁胶体:Fe3+ +3H2O ![]() Fe(OH)3(胶体) + 3H+
Fe(OH)3(胶体) + 3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近科学家获得了一种稳定性好、抗氧化能力强的活性化合物A;其结构如下:
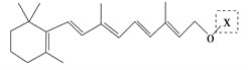
为了研究X的结构,将化合物A在一定条件下水解只得到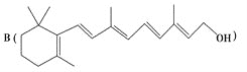 和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
请回答下列问题:
(1)化合物B能发生下列哪些类型的反应________。
A.取代反应 B.加成反应
C.缩聚反应 D.氧化反应
(2)写出化合物C所有可能的结构简式______________________________。
(3)C可通过下图所示途径合成,并制取冬青油和阿司匹林。

(ⅰ)写出有机物的结构简式:D:______________,C:________________,E:______________。
(ⅱ)写出变化过程中①、⑥的化学方程式(注明反应条件)
反应①__________________________________;反应⑥_____________________________。
(ⅲ)变化过程中的②属于____________反应,⑦属于________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图所示)

(1)制备实验开始时,先检查装置气密性,接下来的操作依次是______(填序号)
A.往烧瓶中加入MnO2粉末 B.加热 C.往烧瓶中加入浓盐酸
(2)制备反应会因盐酸浓度下降而停止.为测定已分离出过量MnO2后的反应残余液中盐酸的浓度,探究小组提出下列实验方案:
甲方案:与足量AgNO3溶液反应,称量生成的AgCl质量。
乙方案:采用酸碱中和滴定法测定。
丙方案:与已知量CaCO3(过量)反应,称量剩余的CaCO3质量。
丁方案:与足量Zn反应,测量生成的H2体积。
继而进行下列判断和实验:判定甲方案不可行,理由是______________。
(3)进行乙方案实验: 准确量取残余清液稀释一定倍数后作为试样。
a.量取试样20.00 mL,用0.1000 mol·L-1NaOH标准溶液滴定,消耗22.00mL,该次滴定测得试样中盐酸浓度为_____mol·L-1
b.平行滴定后获得实验结果。
采用此方案还需查阅资料知道的数据是:________。
(4)丙方案的实验发现,剩余固体中含有MnCO3,说明碳酸钙在水中存在______,测定的结果会:______(填“偏大”、“偏小”或“准确”)
(5)进行丁方案实验:装置如图所示(夹持器具已略去)

①使Y形管中的残余清液与锌粒反应的正确操作是将_________转移到_____________中。
②反应完毕,每间隔1分钟读取气体体积,气体体积逐次减小,直至不变。气体体积逐次减小的原因是______(排除仪器和实验操作的影响因素)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁、明矾可用作净水剂。某课题组拟以废弃的铝铁合金为原料制备聚合硫酸铁和明矾,设计化工流程如下:
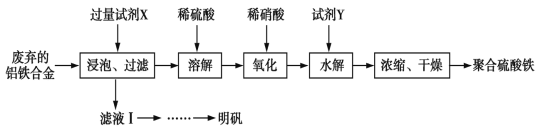
已知:聚合硫酸铁能溶于水,微溶于乙醇,其化学式可表示为[Fe2(OH)x(SO4)y]n。
(1)在聚合硫酸铁中,x、y之间的关系是_______________。试剂X中溶质的化学式为______。
(2)写出上述流程图中的“氧化”的离子方程式:______________该设计存在缺陷,请提出改进意见;________
(3)加入试剂Y的目的是为了调节溶液的pH,若Y为氧化物,写出调节pH的离子方程式:_____
(4)已知常温下Fe(OH)3和Mg(OH)2的Ksp分别为8.0×10-38、1.0×10-11,向浓度均为0.1mol/L的FeCl3、MgCl2 的混合溶液中加入碱液,要使Fe3+ 刚好完全沉淀的pH为____,而Mg2+刚好开始要沉淀的pH为__________。(已知lg 2=0.3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 恒温恒压下,在容积可变的器皿中,反应2NO2 (g)![]() N2O4 (g)达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数
N2O4 (g)达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数
A.减小 B.增大 C.不变 D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的分类或归类正确的是
A.化合物:CaCl2、烧碱、聚苯乙烯、HD
B.电解质:明矾、胆矾、冰醋酸、硫酸钡
C.同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2
D.同位素:![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是一种重要的元素,可用来合成NH3与 HNO3等一系列重要化工产品。
(1)在标准状况下,1体积水溶解700体积氨气,所得溶液的密度为0.9g/mL,则该氨水的物质的量浓度是_______(小数点后保留一位)。
(2)合成氨的原料气N2和H2通常是以焦炭、水和空气为原料来制取的。其主要反应是:
①2C + O2 → 2CO ②C + H2O(g) → CO + H2 ③CO + H2O(g) → CO2 + H2
某次生产中将焦炭、H2O(g)和空气(设空气中N2和O2的体积比为4:1,下同)混合反应,所得气体产物经分析,组成如下表:
气体 | CO | N2 | CO2 | H2 | O2 |
体积(m3)(标准状况) | x | 20 | 12 | 60 | 1.0 |
则计算参加反应的H2O(g)和氧气的体积比V(H2O)/V(氧气)=__________上表中x=________m3,实际消耗了___________ kg焦炭。
(3)工业生产硝酸时尾气必须充分处理以避免环境污染,常用NaOH溶液吸收,吸收时发生反应:
①2NO2 + 2NaOH→NaNO3 + NaNO2 + H2O
②NO + NO2 + 2NaOH→2NaNO2 + H2O
现将22.4升(标准状况)NOx(只含NO、NO2,忽略其它成分)气体缓缓通入足量NaOH溶液中,充分反应,气体全部被吸收。则反应中产生NaNO3和NaNO2各多少克?(用含x的代数式表示)____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法对应的离子方程式合理的是
A.纯碱溶液去油污:CO32-+H2O==HCO3-+OH-
B.泡沫灭火器工作原理:2Al3++3CO32-+3H2O==2Al(OH)3↓+3CO2↑
C.铝溶于烧碱溶液:Al+2OH-==AlO2-+H2↑
D.用石墨为电极,电解Pb(NO3)2和Cu(NO3)2的混合溶液制取PbO2时,阳极上发生的电极反应式:Pb2++2H2O-2e-==PbO2+4H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com