
【题目】下列说法对应的离子方程式合理的是
A.纯碱溶液去油污:CO32-+H2O==HCO3-+OH-
B.泡沫灭火器工作原理:2Al3++3CO32-+3H2O==2Al(OH)3↓+3CO2↑
C.铝溶于烧碱溶液:Al+2OH-==AlO2-+H2↑
D.用石墨为电极,电解Pb(NO3)2和Cu(NO3)2的混合溶液制取PbO2时,阳极上发生的电极反应式:Pb2++2H2O-2e-==PbO2+4H+
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】水的电离过程为H2O![]() H++OH,在不同温度下其离子积为Kw(25℃)=1.0×1014,Kw(35℃)=2.1×1014,则下列叙述正确的是
H++OH,在不同温度下其离子积为Kw(25℃)=1.0×1014,Kw(35℃)=2.1×1014,则下列叙述正确的是
A.c(H+)随着温度的升高而降低
B.在35 ℃ 的纯水中时,c(H+)>c(OH)
C.水的电离常数Kw(25℃)>Kw(35℃)
D.水的电离是一个吸热过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值,以下说法正确的是
A.2NA个HCl分子与44.8 L H2和Cl2的混合气体所含的原子数目均为4NA。
B.32gCu将足量浓、稀硝酸分别还原为NO2和NO,浓、稀硝酸得到的电子数均为NA。
C.物质的量浓度均为1mol/L的NaCl和MgCl2混合溶液中,含有Cl―的数目为3NA。
D.1mol D318O+(其中D代表![]() )中含有的中子数为10 NA。
)中含有的中子数为10 NA。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质存在如图所示的转化关系,已知C、G、H为中学常见的单质,其中G 固态时呈紫黑色,C、H在通常状况下为气体,实验室常用E在B的催化加热下制单质H。
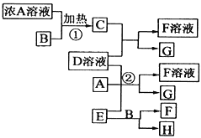
(1)写出B物质的名称 _______________________ ;
(2)写出①的化学反应方程式 ___________________________________________________ ;
(3)写出②的离子方程式_____________________________________________________________;
(4)在D溶液中通入C 后的溶液中,分离出G 的操作名称是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废镍(含NiO,杂质为少量Fe2O3)生产Ni2O3的一种工艺流程如下:
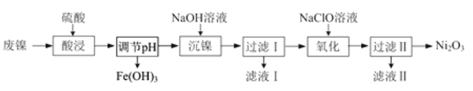
(1)“酸浸”时为了提高酸浸的速率(浸取率),可采取的措施有_____________(任写出一条)。
(2)“酸浸”时Fe2O3发生反应的离子方程式:____________________________________。
(3)“调节pH”使溶液中的Fe3+沉淀完全(离子浓度≤10-5mol·L-1时,离子沉淀完全),则需维持c(OH-)不低于__________ [已知Fe(OH)3的Ksp=4×10-38,![]() ≈1.6 ]。
≈1.6 ]。
(4)“沉镍”的目的是将溶液中的Ni2+转化为Ni(OH)2沉淀,确认Ni2+已经完全沉淀的实验方法是_____________________________________。
(5)“滤液Ⅱ”所含阴离子主要为Cl-,写出“氧化”时反应的离子方程式:____________________。
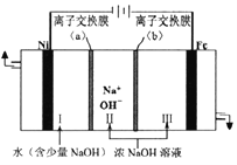
(6)以Fe、Ni为电极制取Na2FeO4的原理如图所示。通电后,在铁电极附近生成紫红色的![]() 。电解时阳极的电极反应式为___________________________________,离子交换膜(b)为______(填“阴”或“阳”)离子交换膜。
。电解时阳极的电极反应式为___________________________________,离子交换膜(b)为______(填“阴”或“阳”)离子交换膜。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研制了一种新型的高比能量锌-碘溴液流电池,其工作原理示意图如下。图中贮液器可储存电解质溶液,提高电池的容量。下列叙述不正确的是
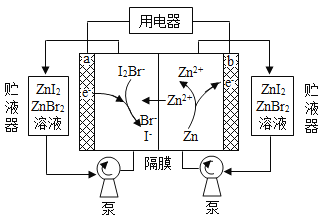
A. 放电时,a电极反应为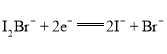
B. 放电时,溶液中离子的数目增大
C. 充电时,b电极每增重![]() ,溶液中有
,溶液中有![]() 被氧化
被氧化
D. 充电时,a电极接外电源负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列各题。
(1)从下列物质中选择对应类型的物质的序号填空。
① CH3OCH3 ② HCOOCH2CH3③CH3COCH3④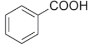 ⑤CH3CHO ⑥
⑤CH3CHO ⑥![]() ⑦
⑦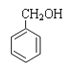
A. 属于羧酸的是________; (填序号,下同) B. 属于酯的是________;
C. 属于醇的是__________; D. 属于酮的是________。
(2)下列各组物质:
① O2和O3;②乙醇和甲醚;③ 淀粉和纤维素;④ 苯和甲苯;⑤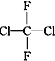 和
和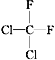 ;⑥
;⑥ 和
和![]() ;⑦ CH3CH2NO2和
;⑦ CH3CH2NO2和![]()
A.互为同系物的是_________;(填序号,下同) B.互为同分异构体的是________;
C.属于同一种物质的是__________; D. 互为同素异形体的是________。
(3)为了测定芳香烃A的结构,做如下实验:
①将9.2g该芳香烃A完全燃烧,生成标况下15.68L CO2和7.2gH2O;
②用质谱仪测定其相对分子质量,得如图所示的质谱图,由图可知该分子的相对分子质量是________,有机物A的分子式为_________。
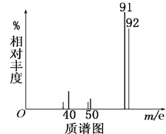
③用核磁共振仪处理该有机物得到四个峰,且四个峰的面积之比是1∶2∶2∶3,则该有机物A的结构简式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硅(Si3N4)是一种重要的陶瓷材料,可用石英与焦炭在1400~1450℃的氮气气氛下合成:3SiO2(s)+6C(s)+2N2(g)![]() Si3N4(s)+6CO(g)﹣Q(Q>0),在反应条件下,向10L密闭容器中加入反应物,10min后达到平衡。完成下列填空:
Si3N4(s)+6CO(g)﹣Q(Q>0),在反应条件下,向10L密闭容器中加入反应物,10min后达到平衡。完成下列填空:
(1)上述反应所涉及的元素,原子半径由大到小的顺序是______。其中一种元素的原子核外s电子数与p电子数相等,写出它的最外层电子排布的轨道表示式______。比较碳、硅两种元素的非金属性强弱,可以通过比较______(填:化合物性质的差异)来判断
(2)上述反应混合物中的极性分子是______,写出非极性分子的电子式______。从晶体类型的角度分析用氮化硅制造发动机中耐热部件的原因是______
(3)下列措施可以提高二氧化硅转化率的是______(选填编号)
a.增加二氧化硅用量b.升高反应温度
c.增大气体压强 d.向反应容器中多充入氮气
(4)下列描述中能说明反应已达平衡的是______(选填编号)
a.c(CO)=3c(N2)
b.v (CO)=3v(N2)
c.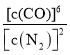 保持不变
保持不变
d.气体的压强保持不变
(5)测得平衡时固体质量减少了11.2g,则用氮气表示的平均反应速率为______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2010年诺贝尔化学奖获得者赫克、伊智根岸(美)和铃木彰(日)在钯催化交叉偶联反应方面的研究,为化学家提供了更为精确、有效的工具,极大促进了制造复杂化学物质的可能性。已知一种钯催化的交叉偶联反应可以表示为:
![]()
下面是利用钯催化的交叉偶联反应,以烃A与苯为原料合成某个复杂分子L(相对质量不超过200)的过程,其中F在浓硫酸作用下可以发生两种不同的反应分别形成H和G。
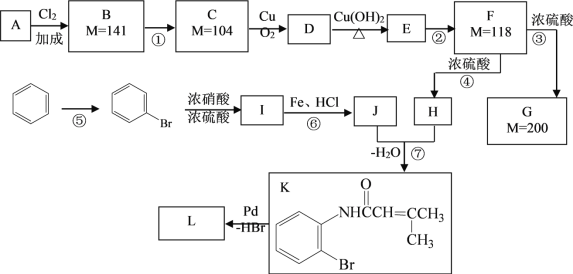
(1)写出反应的反应类型:④____________ ⑥________________ ;
(2)写出反应需要的无机反应物、反应条件:
①_______________,⑤_________________;
(3)根据要求完成下列两个空格:
用系统命名法给物质A命名:________________;
写出物质L的结构简式:__________________。
(4)写出下列反应的化学方程式:
C→D:_________________________;
F→G:_________________________。
(5)H有多种同分异构体,请写出一种符合下列条件的结构简式:_________。
i. 能发生水解反应 ii. 分子中只含有两个甲基 iii. 不含环状结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com