
【题目】下列有关物质的分类或归类正确的是
A.化合物:CaCl2、烧碱、聚苯乙烯、HD
B.电解质:明矾、胆矾、冰醋酸、硫酸钡
C.同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2
D.同位素:![]() 、
、![]() 、
、![]()
科目:高中化学 来源: 题型:
【题目】25℃时,向盛有50mL pH=2的HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示。下列叙述正确的是
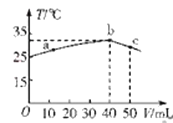
A. HA溶液的物质的量浓度为0.0l mol·L-1
B. b→c的过程中,温度降低的原因是溶液中发生了吸热反应
C. a→b的过程中,混合溶液中可能存在:c(A-)=c(Na+)
D. 25℃时,HA的电离平衡常数K约为1.43×10-2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知硫酸亚铁溶液中加入过氧化钠时发生反应:4Fe2++4Na2O2+6H2O=4Fe(OH)3↓+O2↑+8Na+,则下列说法正确的是
A.该反应中Fe2+是还原剂,O2是还原产物
B.4 mol Na2O2在反应中共得到8NA个电子
C.每生成0.2 mol O2,则被Fe2+还原的氧化剂为0.4 mol
D.反应过程中可以看到白色沉淀转化为灰绿色再转化为红褐色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离过程为H2O![]() H++OH,在不同温度下其离子积为Kw(25℃)=1.0×1014,Kw(35℃)=2.1×1014,则下列叙述正确的是
H++OH,在不同温度下其离子积为Kw(25℃)=1.0×1014,Kw(35℃)=2.1×1014,则下列叙述正确的是
A.c(H+)随着温度的升高而降低
B.在35 ℃ 的纯水中时,c(H+)>c(OH)
C.水的电离常数Kw(25℃)>Kw(35℃)
D.水的电离是一个吸热过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯是仅次于乙烯的有机化工原料,可由丙烷脱氢氧化制取。丙烷脱氢氧化工艺包含的反应有:
主反应:①C3H8(g)![]() C3H6(g)+H2(g) △H1=+124.27 kJ·mol-1(脱氢反应)
C3H6(g)+H2(g) △H1=+124.27 kJ·mol-1(脱氢反应)
②H2(g)+![]() O2(g)=H2O(g) △H2=-241.82 kJ·mol-1(烧氢反应)
O2(g)=H2O(g) △H2=-241.82 kJ·mol-1(烧氢反应)
副反应:③C3H8(g)![]() CH4(g)+C2H4(g) △H3=+81.30 kJ·mol-1
CH4(g)+C2H4(g) △H3=+81.30 kJ·mol-1
④C2H4(g)+H2(g)![]() C2H6(g) △H4=-136.94 kJ·mol-1
C2H6(g) △H4=-136.94 kJ·mol-1
⑤C3H8(g)+H2(g)![]() CH4(g)+C2H6(g) △H5
CH4(g)+C2H6(g) △H5
回答下列问题:
(1)△H5=____kJ·mol-1。
(2)图1是制备工艺中一些反应平衡常数的对数值与温度的关系图,欲提高丙烯的产率,能否尽可能的提高反应温度?_________,其原因是__________________。除温度外,下列还可提高丙烯产率的措施有_________(填序号)

A 降低压强 B 增大压强
C 采用选择性优良的催化剂 D 选择性的氧化消除部分氢气
(3)实际脱氢工艺中常常通入水蒸汽,以改变丙烷的平衡转化率。图2为常压、600~1000K时,不同水烃比M下丙烷脱氢反应的平衡转化率变化图。由图可知,常压、温度恒定时水烃比对平衡转化率的影响规律为____________。设某温度、1 atm(记为p0)下丙烷的脱氢转化率为y,加入反应体系的水蒸汽与原料丙烷的物质的量之比为M,则脱氢反应的平衡常数Kp=____(Kp为以分压表示的平衡常数,写出表达式即可)。
(4)当反应温度为923K时,计算可知脱氢反应的反应热为+115.66 kJ·mol-1,烧氢反应的反应热为-237.75 kJ·mol-1,为保证烧氢所放热量完全满足脱氢吸热之用(假设脱氢率为100%),则烧氢率应大于_____;由此可见,烧氢过程不仅可以提高丙烷脱氢的转化率,还可以_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图表示反应M (g) + N (g)![]() 2R(g)过程中能量变化,下列有关叙述正确的是
2R(g)过程中能量变化,下列有关叙述正确的是

A.由图可知,2molR的能量高于1molM和1molN的能量和
B.曲线B代表使用了催化剂,反应速率加快,M的转化率: 曲线B >曲线A
C.1molM和1molN的总键能高于2molR的总键能
D.对反应2R(g) ![]() M (g) + N (g)使用催化剂没有意义
M (g) + N (g)使用催化剂没有意义
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯氨是氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2Cl、NHCl2和NCl3),副产物少于其它水消毒剂。回答下列问题:
(1)①一氯胺(NH2Cl)的电子式为 ________________ 。
②工业上可利用反应Cl2(g)+NH3(g)=NH2Cl(g)+HCl(g)制备一氯胺,已知部分化学键的键能如下表所示(假设不同物质中同种化学键的键能相同),则该反应的△H=________。
化学键 | N-H | Cl-Cl | N-Cl | H-Cl |
键能(kJ/mol) | 391 | 243 | 191 | 431 |
③一氯胺是重要的水消毒剂,其原因是由于一氯胺在中性、酸性环境中会发生水解,生成具有强烈杀菌消毒作用的物质,该反应的化学方程式为_________________________________。
(2)用Cl2和NH3反应制备二氯胺的方程式为2Cl2(g)+NH3(g)![]() NHCl2(l)+2HCl(g),向容积均为1 L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2 mol Cl2和2 mol NH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
NHCl2(l)+2HCl(g),向容积均为1 L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2 mol Cl2和2 mol NH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(Cl2)(甲容器)/mol | 2.00 | 1.50 | 1. 10 | 0.80 | 0.80 |
n(Cl2) (乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①甲容器中,0~40 min内用NH3的浓度变化表示的平均反应速率v(NH3)=___________。
②该反应的△H________0(填“>”或“<”) 。
③对该反应,下列说法正确的是______________(填选项字母)。
A.若容器内气体密度不变,则表明反应达到平衡状态
B.若容器内Cl2和NH3物质的量之比不变,则表明反应达到平衡状态
C.反应达到平衡后,其他条件不变,在原容器中充入一定量氦气,Cl2的转化率增大
D.反应达到平衡后,其他条件不变,加入一定量的NHCl2,平衡向逆反应方向移动
(3)在恒温条件下,2molCl2和1molNH3发生反应2Cl2(g)+NH3(g)![]() NHCl2(l)+2HCl(g),测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示:
NHCl2(l)+2HCl(g),测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示:

①A、B、C三点中Cl2转化率最高的是______点(填“A”“B”或“C”)。(提示:C点时HCl和Cl2的浓度相等)
②计算C点时该反应的压强平衡常数Kp(C)=_________(Kp是平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值,以下说法正确的是
A.2NA个HCl分子与44.8 L H2和Cl2的混合气体所含的原子数目均为4NA。
B.32gCu将足量浓、稀硝酸分别还原为NO2和NO,浓、稀硝酸得到的电子数均为NA。
C.物质的量浓度均为1mol/L的NaCl和MgCl2混合溶液中,含有Cl―的数目为3NA。
D.1mol D318O+(其中D代表![]() )中含有的中子数为10 NA。
)中含有的中子数为10 NA。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列各题。
(1)从下列物质中选择对应类型的物质的序号填空。
① CH3OCH3 ② HCOOCH2CH3③CH3COCH3④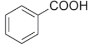 ⑤CH3CHO ⑥
⑤CH3CHO ⑥![]() ⑦
⑦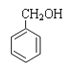
A. 属于羧酸的是________; (填序号,下同) B. 属于酯的是________;
C. 属于醇的是__________; D. 属于酮的是________。
(2)下列各组物质:
① O2和O3;②乙醇和甲醚;③ 淀粉和纤维素;④ 苯和甲苯;⑤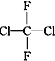 和
和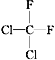 ;⑥
;⑥ 和
和![]() ;⑦ CH3CH2NO2和
;⑦ CH3CH2NO2和![]()
A.互为同系物的是_________;(填序号,下同) B.互为同分异构体的是________;
C.属于同一种物质的是__________; D. 互为同素异形体的是________。
(3)为了测定芳香烃A的结构,做如下实验:
①将9.2g该芳香烃A完全燃烧,生成标况下15.68L CO2和7.2gH2O;
②用质谱仪测定其相对分子质量,得如图所示的质谱图,由图可知该分子的相对分子质量是________,有机物A的分子式为_________。
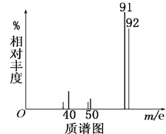
③用核磁共振仪处理该有机物得到四个峰,且四个峰的面积之比是1∶2∶2∶3,则该有机物A的结构简式为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com