
【题目】丙烯是仅次于乙烯的有机化工原料,可由丙烷脱氢氧化制取。丙烷脱氢氧化工艺包含的反应有:
主反应:①C3H8(g)![]() C3H6(g)+H2(g) △H1=+124.27 kJ·mol-1(脱氢反应)
C3H6(g)+H2(g) △H1=+124.27 kJ·mol-1(脱氢反应)
②H2(g)+![]() O2(g)=H2O(g) △H2=-241.82 kJ·mol-1(烧氢反应)
O2(g)=H2O(g) △H2=-241.82 kJ·mol-1(烧氢反应)
副反应:③C3H8(g)![]() CH4(g)+C2H4(g) △H3=+81.30 kJ·mol-1
CH4(g)+C2H4(g) △H3=+81.30 kJ·mol-1
④C2H4(g)+H2(g)![]() C2H6(g) △H4=-136.94 kJ·mol-1
C2H6(g) △H4=-136.94 kJ·mol-1
⑤C3H8(g)+H2(g)![]() CH4(g)+C2H6(g) △H5
CH4(g)+C2H6(g) △H5
回答下列问题:
(1)△H5=____kJ·mol-1。
(2)图1是制备工艺中一些反应平衡常数的对数值与温度的关系图,欲提高丙烯的产率,能否尽可能的提高反应温度?_________,其原因是__________________。除温度外,下列还可提高丙烯产率的措施有_________(填序号)

A 降低压强 B 增大压强
C 采用选择性优良的催化剂 D 选择性的氧化消除部分氢气
(3)实际脱氢工艺中常常通入水蒸汽,以改变丙烷的平衡转化率。图2为常压、600~1000K时,不同水烃比M下丙烷脱氢反应的平衡转化率变化图。由图可知,常压、温度恒定时水烃比对平衡转化率的影响规律为____________。设某温度、1 atm(记为p0)下丙烷的脱氢转化率为y,加入反应体系的水蒸汽与原料丙烷的物质的量之比为M,则脱氢反应的平衡常数Kp=____(Kp为以分压表示的平衡常数,写出表达式即可)。
(4)当反应温度为923K时,计算可知脱氢反应的反应热为+115.66 kJ·mol-1,烧氢反应的反应热为-237.75 kJ·mol-1,为保证烧氢所放热量完全满足脱氢吸热之用(假设脱氢率为100%),则烧氢率应大于_____;由此可见,烧氢过程不仅可以提高丙烷脱氢的转化率,还可以_________。
【答案】-55.64 不能 在高温下副反应③比脱氢反应更容易进行 ACD 水烃比越大,脱氢反应平衡转化率越高 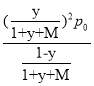 48.6% 降低能耗
48.6% 降低能耗
【解析】
(1)由题目中给出的热化学方程式之间的关系可得![]() =
=![]() +
+![]() ;
;
(2)由图1可知,在高温下副反应③比脱氢反应更容易进行;提高丙烯产率可以使主反应正向进行,或加快主反应速率,抑制副反应的发生;
(3)水烃比值越大,相当于只有烃分解,扩大体积,减小压强,比值越大,正向移动程度越大;根据“三段式”计算出C3H8(g)C3H6(g)+H2(g)平衡时每种物质的物质的量关系,进而进行计算;
(4)烧氢放出的热量为脱氢提供热量,依据量的关系进行计算。
(1)由③C3H8(g)![]() CH4(g)+C2H4(g) △H3=+81.30 kJ·mol-1
CH4(g)+C2H4(g) △H3=+81.30 kJ·mol-1
④C2H4(g)+H2(g)![]() C2H6(g) △H4=-136.94 kJ·mol-1
C2H6(g) △H4=-136.94 kJ·mol-1
可知⑤C3H8(g)+H2(g)![]() CH4(g)+C2H6(g)可以由③+④得到,所以
CH4(g)+C2H6(g)可以由③+④得到,所以![]() =
=![]() +
+![]() =+81.30kJ·mol-1+(-136.94kJ·mol-1)=-55.64kJ·mol-1;
=+81.30kJ·mol-1+(-136.94kJ·mol-1)=-55.64kJ·mol-1;
(2)由图可知,欲提高丙烯的产率,不能尽可能的提高反应温度,因为在高温下副反应③比脱氢反应更容易进行;降低压强、选择性的氧化消除部分氢气可以使主反应正向进行,采用选择性优良的催化剂可以加快主反应速率,降低副反应进行程度,提高丙烯产率;
(3)水烃比值越大,相当于只有烃分解,扩大体积,减小压强;比值越大,正向移动程度越大,即水烃比越大,脱氢反应平衡转化率越高;
假设丙烷为1mol,则有:
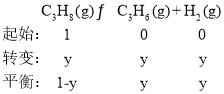
Kp=![]() =
= =
=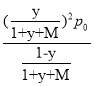 ;
;
(4)由题意可知,烧氢放出的热量为脱氢提供热量,依据量的关系可得:烧氢率应大于![]() =48.6%,由此可见,烧氢过程不仅可以提高丙烷脱氢的转化率,还可以降低能耗。
=48.6%,由此可见,烧氢过程不仅可以提高丙烷脱氢的转化率,还可以降低能耗。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】实验室一试剂瓶的标签严重破损,只能隐约看到下列一部分“ ”取该试剂瓶中的试剂,通过燃烧实验测得:16.6g 该物质完全燃烧得到39.6g CO2与9g H2O.
”取该试剂瓶中的试剂,通过燃烧实验测得:16.6g 该物质完全燃烧得到39.6g CO2与9g H2O.
(1)通过计算可知该有机物的分子式为:______.
(2)进一步实验可知:
①该物质能与碳酸氢钠溶液反应生成无色无味气体.
②16.6g 该物质与足量金属钠反应可生成氢气2.24L(已折算成标准状况).则该物质的结构可能有__种,请写出其中任意两种同分异构体的结构简式____.
(3)若下列转化中的D是中可能结构中的一种,且可发生消去反应;E含两个六元环;取C在NaOH水溶液中反应后的混合液,加入足量硝酸酸化后,再加入硝酸银溶液,出现白色沉淀.
![]()
A的结构简式为_____.
(4)写出A转化成B的化学方程式:_____.
(5)反应类型:C→D的①____,D→E_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液X含有K+、Mg2+、Fe3+、Al3+、Fe2+、Cl-、CO32-、OH-、SiO32-、NO3-、SO42-中的几种,已知该溶液中各离子物质的量浓度均为0.2mol·L-1(不考虑水的电离及离子的水解)。为确定该溶液中含有的离子,现进行了如下的操作:

下列说法正确的是
A.无色气体可能是NO和CO2的混合物
B.原溶液可能存在Fe3+
C.溶液X中所含离子种类共有4种
D.另取l00mL原溶液X,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,理论上得到的固体质量为2.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁、明矾可用作净水剂。某课题组拟以废弃的铝铁合金为原料制备聚合硫酸铁和明矾,设计化工流程如下:
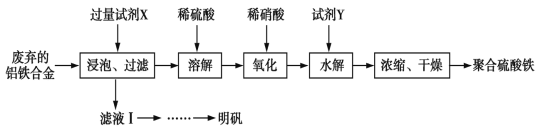
已知:聚合硫酸铁能溶于水,微溶于乙醇,其化学式可表示为[Fe2(OH)x(SO4)y]n。
(1)在聚合硫酸铁中,x、y之间的关系是_______________。试剂X中溶质的化学式为______。
(2)写出上述流程图中的“氧化”的离子方程式:______________该设计存在缺陷,请提出改进意见;________
(3)加入试剂Y的目的是为了调节溶液的pH,若Y为氧化物,写出调节pH的离子方程式:_____
(4)已知常温下Fe(OH)3和Mg(OH)2的Ksp分别为8.0×10-38、1.0×10-11,向浓度均为0.1mol/L的FeCl3、MgCl2 的混合溶液中加入碱液,要使Fe3+ 刚好完全沉淀的pH为____,而Mg2+刚好开始要沉淀的pH为__________。(已知lg 2=0.3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.1 L 1mol·L-1的NH4Fe(SO4)2溶液中,Fe3+数目与SO42-数目之比为1:2
B.标况下,22.4 L NO2与足量水反应生成0.5NA个NO分子
C.1 mol石墨和金刚石的混合物中,含碳碳键数目为4NA
D.K37ClO3+6H35Cl=3Cl2↑+KCl+3H2O若该反应转移5NA个电子,则生成212 g Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的分类或归类正确的是
A.化合物:CaCl2、烧碱、聚苯乙烯、HD
B.电解质:明矾、胆矾、冰醋酸、硫酸钡
C.同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2
D.同位素:![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000 mol·L-1NaOH溶液滴定20.00 mL 0.1000 mol·L-1HA溶液,滴定曲线如图。下列说法不正确的是
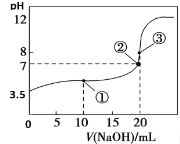
A. 常温下,HA电离常数为1.0×10-6
B. 点②所示溶液中:c(Na+)< c(HA)+c(A-)
C. 点③所示溶液中:c(Na+)> c(A-)> c(OH-)>c(H+)
D. 从点①到点③的滴定过程中,水的电离程度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是一种极其重要的元素,工业上,生活中到处可见。
(1)碳原子核外有________种能量不同的电子,这些电子占据了______个纺锤形轨道。
(2)下列方法可以比较碳与硫的非金属性强弱的是__________
a.比较原子最外层电子数多少 b.比较其最高价氧化物对应水化物的酸性
c.比较气态氢化物的稳定性 d.比较单质的熔沸点高低
(3)煤的气化是煤高效洁净利用的方向之一。在一定温度下的某容积可变的密闭容器中 建立下列化学平衡:C(s)+H2O(g)![]() CO(g)+H2(g)-Q,可认定该可逆反应在一定条件下已达到化学平衡状态的是_____(选填序号)。
CO(g)+H2(g)-Q,可认定该可逆反应在一定条件下已达到化学平衡状态的是_____(选填序号)。
a.体系的压强不再发生变化 b.v正(CO)=v逆(H2O)
c.生成n molCO的同时生成n mol H2 d.1mol H-H键断裂同时断裂2mol H-O键
(4)若上述化学平衡状态从正反应开始建立,达到平衡后,给平衡体系加压(缩小体积),则容器内气体的平均相对分子质量将______(填写不变、变小、变大、无法确定)。若工业上以此方法生产水煤气,提高产率的措施为____。(写出两条措施)
(5)空气中的CO2浓度增大,会导致温室效应,有人提出将CO2通过管道输送到海底,这可减缓空气中CO2浓度的增加。但长期下去,海水的酸性也将增强,破坏海洋的生态系统。请你结合CO2的性质,从平衡角度分析酸性增强原因 _____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接排放含SO2的烟气会危害环境。利用工业废碱渣(主要成分Na2CO3)可吸收烟气中的SO2并制备无水Na2SO3,其流程如图。
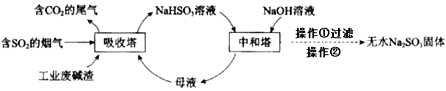
下列说法中不正确的是
A.吸收塔中的温度不宜过高,原因可能是防止SO2的溶解度下降
B.为提高NaHSO3的产率,应控制吸收塔中溶液为弱碱性
C.吸收塔中生成HSO3-的离子方程式是2SO2+CO32-+H2O=2HSO3-+CO2↑
D.操作②为蒸馏水洗涤、干燥,得无水Na2SO3固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com