
【题目】已知NA是阿伏加德罗常数的值,下列说法错误的是( )
A.标准状况下0.5molNT3分子中所含中子数为6.5NA
B.0.1molFe与0.1molCl2完全反应后,转移的电子数为0.2NA
C.13.35gAlCl3水解形成的Al(OH)3胶体粒子数小于0.1NA
D.一定条件下的密闭容器中,2molSO2和1molO2催化反应充分发生后分子总数为2NA
科目:高中化学 来源: 题型:
【题目】如右图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中。下列分析正确的()
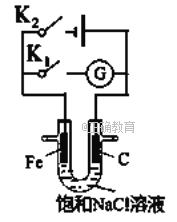
A. K1闭合,铁棒上发生的反应为2H++2e-=H2↑
B. K1闭合,石墨棒周围溶液碱性增强
C. K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D. K2闭合,电路中通过0.002NA个电子时,两极共产生0.001mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积相同的两个密闭容器M和N中,保持温度为150 ℃,向M容器中加入a mol HI,同时向N容器中加入b mol HI (a>b)。当反应2HI(g)![]() H2 (g) + I2 (g) 达到平衡后,下列说法正确的是
H2 (g) + I2 (g) 达到平衡后,下列说法正确的是
A.从反应开始到达到平衡,所需时间tM > tN
B.平衡时cM(I2) = c N(I2)
C.平衡时I2 蒸气在混合气体中的体积分数:M > N
D.HI的平衡分解率αM = αN
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将2molCO和3molH2O混合于2L的密闭容器中,发生如下可逆反应:CO(g)+H2O(g)![]() CO2(g)+H2(g);
CO2(g)+H2(g);
(1)该化学反应的平衡常数表达式:___。
(2)已知在700℃时,该反应的平衡常数K1=2,则该温度下反应CO2(g)+H2(g)CO(g)+H2O(g)的平衡常数K2=__,反应2CO(g)+2H2O(g)2CO2(g)+2H2(g)的平衡常数K3=___。
(3)已知在1000℃时,该反应的平衡常数K4=1.0,则该反应为___反应(填“吸热”或“放热”),△H__0(填“>”或“<”)。
(4)在1000℃下,某时刻CO2的物质的量为1mol,则此时υ(正)__υ(逆)(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸是草本植物常具有的成分。查阅相关资料得到草酸晶体(H2C2O4·3H2O)及其盐的性质如下表。

(1)草酸晶体(H2C2O4·3H2O)175℃以上会发生分解生成三种氧化物,某实验小组欲通过实验证明这三种氧化物。
①该小组选用装置丙作为分解装置,不选用甲装置的原因是________________。丙装置相对于乙装置的优点是____________。实验前检验该装置气密性的操作方法是_________。

②从下图选用合适的装置,验证分解产生的气体,装置的连接顺序是____________。(用装置编号表示,某些装置可以重复使用,也可以装不同的试剂)

③B装置的作用是________________________。
(2)某实验小组称取4.0g粗草酸晶体配成100mL溶液,采用0.1mol·L-1酸性高锰酸钾溶液滴定该草酸溶液,测定该草酸晶体的纯度。
①配制草酸溶液需要用到的主要玻璃仪器有_______________。
②本实验达到滴定终点的标志是______________________。
③将所配草酸分为四等份,实验测得每份平均消耗酸性高锰酸钾溶液20mL。计算该粗草酸中含草酸晶体的质量为_______g(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.100mol/LHCl溶液滴定0.100mol/LNa2CO3溶液的滴定曲线如图,已知f=![]() 。下列说法错误的是
。下列说法错误的是
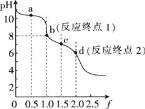
A.a点溶液中:c(HCO3-)>c(CO32-)
B.b点溶液中:c(Na+)>c(HCO3-)+c(CO32-)+c(H2CO3)
C.c点溶液中:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
D.溶液中水的电离程度:a>b>c>d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将NaOH溶液滴加到HA溶液中,测得混合溶液的pH与p![]() 转化关系如图所示[已知:p
转化关系如图所示[已知:p![]() =-lg
=-lg![]() ]。下列叙述错误的是( )
]。下列叙述错误的是( )
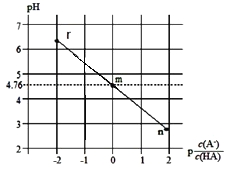
A.m点:c(A-)=c(HA)
B.Ka(HA)的数量级为10-6
C.水的电离程度:m<r
D.r点:c(H+)+c(Na+)=c(A-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇催化氧化制取乙醛(沸点为20.8℃,能与水混溶)的装置(夹持装置已略)如图所示:
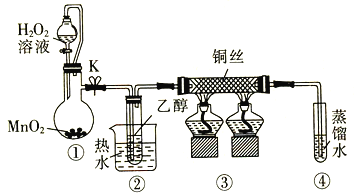
下列说法错误的是
A.向圆底烧瓶中滴入H2O2溶液前需打开K
B.实验开始时需先加热②,再通O2,然后加热③
C.装置③中发生的反应为2CH3CH2OH +O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
D.实验结束时需先将④中的导管移出。再停止加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中药药剂砒霜(主要成分As2O3,微溶于水)在医疗上用于治疗急性白血病。某课题组以一种含砷精矿石粉(主要成份为As4S4、As2S3、FeS2及其它惰性杂质)为原料制取As2O3,工艺流程图如下:

(1)过程 I 中所得SO2气体可回收再利用,下列有关SO2用途的说法正确的是_______。
A 工业制硫酸 B 漂白纸张 C 自来水消毒
(2)过程II中发生的反应_______氧化还原反应(填“是”或“不是”)。
(3)过程V中操作为_______(填实验基本操作名称)。
(4)①检验Na3AsO3溶液中是否含有Fe3+的实验操作_______。
②过程IV中生成As2O3的离子反应方程式为_______。
(5)有毒的AsO33-通过电解反应可转化为无毒的AsO43-。用石墨为电极,在强碱性溶液中电解含AsO33-的溶液,阳极的电极反应式为_______。
(6)测定某As2O3粗产品(含As2O5杂质)中As2O3的质量分数的实验过程如下:
a.称取m g粗产品溶解于NaOH溶液,得到含AsO33-、AsO43-的混合溶液100mL。
b.分别移取25.00mL上述溶液,用0.02500mol·L1的I2标准溶液进行滴定(I2将AsO33-氧化为AsO43-,淀粉溶液为指示剂)。每次滴定开始时液面读数如图一所示,三次滴定结束时,I2 标准溶液液面读数如图二~图四所示。

①描述滴定终点的现象_______。
②粗产品中As2O3的质量分数为_______(用含有m的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com