
【题目】有机化合物A是一种重要的化工原料,合成路线如下:
 已知以下信息:
已知以下信息:
①
② R—CH===CH2![]() R—CH2CH2OH;
R—CH2CH2OH;
③核磁共振氢谱显示A有2种不同化学环境的氢。
(1)A 的名称是________。F的结构简式为________。
(2)A―→B的反应类型为________。I中存在的含氧官能团的名称是________。
(3)写出下列反应的化学方程式。
D―→E:__________。
(4)I的同系物J比I相对分子质量小28,J的同分异构体中能同时满足如下条件的共有________种(不考虑立体异构)。
①苯环上只有两个取代基;②既含-CHO,又能和饱和NaHCO3溶液反应放出CO2
(5)参照上述合成路线,以 为原料(无机试剂任选),设计制备苯乙酸(
为原料(无机试剂任选),设计制备苯乙酸(![]() )的合成路线:__________________________
)的合成路线:__________________________
【答案】2-甲基-2-丙醇(或叔丁醇) ![]() 消去反应 酯基、醛基
消去反应 酯基、醛基 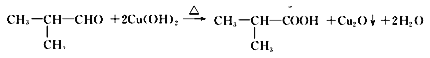 6
6 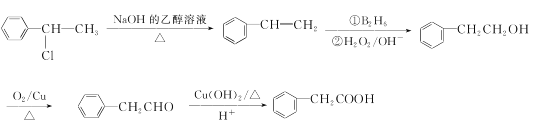
【解析】
结合流程图,A分子中含有4个碳原子,所以E分子中碳原子数是4,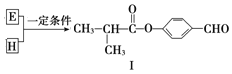 ,E、F发生酯化反应生成I,E是
,E、F发生酯化反应生成I,E是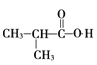 、H是
、H是![]() ;利用逆推法,
;利用逆推法,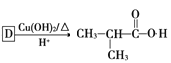 ,D是
,D是 ;根据R—CH===CH2
;根据R—CH===CH2![]() R—CH2CH2OH,C是醇,C发生氧化反应生成
R—CH2CH2OH,C是醇,C发生氧化反应生成 ,则C是
,则C是![]() 、B是
、B是![]() ;核磁共振氢谱显示A有2种不同化学环境的氢,A发生消去反应生成
;核磁共振氢谱显示A有2种不同化学环境的氢,A发生消去反应生成![]() ,则A是
,则A是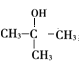 ;H是
;H是![]() ,F光照条件下与氯气发生苯环侧链的取代反应生成G,G水解为
,F光照条件下与氯气发生苯环侧链的取代反应生成G,G水解为![]() ,结合
,结合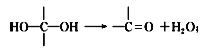 ,利用逆推法,G是
,利用逆推法,G是![]() ,F是
,F是![]() 。
。
(1)根据以上分析,A 是 ,名称是2-甲基-2-丙醇。F的结构简式为
,名称是2-甲基-2-丙醇。F的结构简式为![]() 。
。
(2)  在浓硫酸作用下加热生成
在浓硫酸作用下加热生成![]() ,反应类型为消去反应。I是
,反应类型为消去反应。I是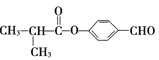 ,存在的含氧官能团的名称是醛基、酯基。
,存在的含氧官能团的名称是醛基、酯基。
(3)  被新制氢氧化铜悬浊液氧化为
被新制氢氧化铜悬浊液氧化为 ,反应方程式是:
,反应方程式是: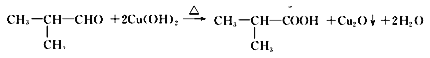 。
。
(4)I的同系物J比I相对分子质量小28,所以J比 少2个碳原子,①苯环上只有两个取代基;②含-CHO,能和饱和NaHCO3溶液反应放出CO2,说明含有羧基,同时满足以上条件的同分异构体,若两个取代基分别是-CHO 和-CH2COOH,在苯环上有邻间对三种结构,若两个取代基分别是-CH2CHO 和-COOH,在苯环上有邻间对三种结构,共6种。
少2个碳原子,①苯环上只有两个取代基;②含-CHO,能和饱和NaHCO3溶液反应放出CO2,说明含有羧基,同时满足以上条件的同分异构体,若两个取代基分别是-CHO 和-CH2COOH,在苯环上有邻间对三种结构,若两个取代基分别是-CH2CHO 和-COOH,在苯环上有邻间对三种结构,共6种。
(5)参照上述合成路线,  发生消去反应生成
发生消去反应生成![]() ,
,![]()
![]() 生成
生成![]() ,
,![]() 氧化为
氧化为![]() ,
,![]() 氧化为
氧化为![]() ,合成路线为:
,合成路线为: 。
。


科目:高中化学 来源: 题型:
【题目】工业上,从精制黑钨矿(FeWO4、MnWO4)中提取金属钨的一种流程如下图所示,该流程同时获取副产物Fe2O3和MnCl2。

已知:I.过程①~④中,钨的化合价均不变;
Ⅱ.常温下钨酸难溶于水;
Ⅲ.25℃时,Ksp[Fe(OH)3]=1.0×10-38,Ksp [Mn(OH)2]=4.0×10-14
回答下列问题:
(1)上述流程中的“滤渣1”除MnO2外还有_____、“气体”除水蒸气、HCl外还有____(均填化学式);
(2)过程①中MnWO4参与反应的化学方程式为______;FeWO4参与的反应中氧化剂与还原剂的物质的量之比为___________;
(3)已知WO3(s)+3H2(g)=W(s)+3H2O(g) ΔH=a kJ·mol-1
WO3(s)=WO3(g) ΔH=b kJ·mol-1
写出WO3(g)与H2(g)反应生成W(s)的热化学方程式:_______;
(4)过程⑦在25℃时调pH,至少应调至_______(当离子浓度等于1.0×10-5mol·L-1时,可认为其已沉淀完全);
(5)过程⑧要获得MnCl2固体,在加热时必须同时采取的一项措施是__________;
(6)钠钨青铜是一类特殊的非化学计量比化合物,其通式为NaxWO3,其中0<x<1,这类化合物具有特殊的物理化学性质,是一种低温超导体。应用惰性电极电解熔融的Na2WO4和WO2混合物可以制备钠钨青铜,写出WO42-在阴极上放电的电极反应式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮、磷化合物在生活和生产中有许多重要用途,如:(CH3)3N、磷化硼(BP)、磷青铜(Cu3SnP)等。
回答下列问题:
(1)锡(Sn)是第五周期ⅣA元素。基态锡原子的价电子排布式为_________,据此推测,锡的最高正价是_________ 。
(2)与P同周期的主族元素中,电负性比P小的元素有____种,第一电离能比P大有____种。
(3)PH3分子的空间构型为___________。PH3的键角小于NH3的原因是__________。
(4)化合物(CH3)3N能溶于水,试解析其原因____________。

(5)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图所示:
①在一个晶胞中磷原子空间堆积方式为________,磷原子的配位数为________。
②已知晶胞边长a pm,阿伏加德罗常数为NA。则磷化硼晶体的密度为______ g/cm3。
③磷化硼晶胞沿着体对角线方向的投影如图,请将表示B原子的圆圈涂黑________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质溶液中离子关系的说法正确的是( )
A. 0.1 mol·L-1NaHCO3溶液中离子浓度关系:c(Na+)=2c(![]() )+c(
)+c(![]() )+c(H2CO3)
)+c(H2CO3)
B. 把0.2 mol/L NH4Cl溶液与0.1 mol/L NaOH溶液等体积混合后离子浓度关系:c(Cl-)>c(![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
C. 常温,向醋酸钠溶液中滴加少量醋酸使其pH=7,则混合液中:c(Na+)=c(CH3COO-)
D. 在Na2CO3溶液中,c(H+)+c(![]() )+c(H2CO3)= c(OH-)
)+c(H2CO3)= c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
A.充电时阳极反应:Ni(OH)2 -e— + OH- = NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某干燥粉末可能由Na2O、Na2O2、Na2CO3、NaHCO3、NaCl中的一种或几种组成。将该粉末与足量的盐酸反应有气体X逸出,X通过足量的NaOH溶液后体积缩小(同温、同压下测定),且有气体剩余。若将原来混合粉末在空气中用酒精灯加热,也有气体放出,且剩余固体的质量大于原混合粉末的质量。下列判断正确的是
①粉末中一定有Na2O、Na2O2、和NaHCO3
②粉末中一定不含有Na2CO3和NaCl
③粉末中一定不含有Na2O2和NaCl
④无法肯定粉末中是否含有Na2CO3和NaCl
A. ①② B. ②③ C. ③④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法正确的是
A. 实验室制取氧气方法有多种,生成1molO2电子转移数一定是4NA
B. 500mL0.2 mol·L-1 K2SO3溶液中含有的离子总数为0.3NA
C. 1mol乙烯和乙醇混合气体,在氧气中充分燃烧,消耗氧气的分子数为3NA
D. 2.24LNH3(标准状况)溶于1L水中得到0.1mol·L-1的氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA 表示阿伏加德罗常数的值,下列说法中正确的是
A.标准状况下,22.4L CCl4 含有的原子数为 5NA
B.1.8g 的 NH4+中含有的电子数为 NA
C.常温常压下,32 g O2 和 O3 的混合气体中所含原子数为 1.5 NA
D.7.1g Cl2 溶于水,转移电子数目为 0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com