
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 Ag2O(s)+SO3(g)��2 SO3(g)
Ag2O(s)+SO3(g)��2 SO3(g)  2 SO2(g)+ O2(g)����Ӧ����10 min�ﵽƽ�⣬���c(SO3)=0.4mol/L��c(SO2)=0.1mol/L�������������в���ȷ���ǣ�����
2 SO2(g)+ O2(g)����Ӧ����10 min�ﵽƽ�⣬���c(SO3)=0.4mol/L��c(SO2)=0.1mol/L�������������в���ȷ���ǣ�����| A����10 min��������ƽ����Ӧ����Ϊ0.005 mol��mol��1��min��1 |
| B��SO3�ķֽ���Ϊ20�� |
| C��������������ܶ�Ϊ40g/L |
| D������������������Ļ�ѧ��Ӧ������ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��������ˮΪ֮��������ˮ��˵����ͬ������ˮ�ͱ���ˮ�������� |
B����ӦA(g)+3B(g) 2C(g)��ƽ����¶Ȳ��䣬����ѹǿ��ƽ�������ƶ���ƽ�ⳣ��Kֵ���� 2C(g)��ƽ����¶Ȳ��䣬����ѹǿ��ƽ�������ƶ���ƽ�ⳣ��Kֵ���� |
| C��SO2�Ĵ�������һ�����ȵķ�Ӧ�������¶ȣ���Ӧ���ʼӿ� |
| D����ⱥ��ʳ��ˮʱ�������ĵ缫��ӦʽΪ��2Cl����2e��=��Cl2 �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

 ��
�� �ɴ�С��˳��Ϊ_________����Ӧ��ʼ���15Сʱ�ڣ��ڵ�_________�ִ����������£��ռ���CH4��ࡣ
�ɴ�С��˳��Ϊ_________����Ӧ��ʼ���15Сʱ�ڣ��ڵ�_________�ִ����������£��ռ���CH4��ࡣ CO(g) +3H2(g) ��H=+206kJ��mol-1���������ʵ�����CH4��H2O(g)����1L�����ܱ�������ij�¶��·�Ӧ�ﵽƽ�⣬��ʱ���CO�����ʵ���ΪO.10 mol,CH4��ƽ��ת����Ϊ91 %������¶��¸÷�Ӧ��ƽ�ⳣ��Ϊ_________ (������ȡ��������
CO(g) +3H2(g) ��H=+206kJ��mol-1���������ʵ�����CH4��H2O(g)����1L�����ܱ�������ij�¶��·�Ӧ�ﵽƽ�⣬��ʱ���CO�����ʵ���ΪO.10 mol,CH4��ƽ��ת����Ϊ91 %������¶��¸÷�Ӧ��ƽ�ⳣ��Ϊ_________ (������ȡ�������� �ֱ�Ϊ
�ֱ�Ϊ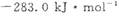 ��
�� ����CH3OH(l)����ȫȼ������CO(g)��H2O(l)���Ȼ�ѧ����ʽΪ_________��
����CH3OH(l)����ȫȼ������CO(g)��H2O(l)���Ȼ�ѧ����ʽΪ_________�� CH3OH (g), ��H<0�ϳɼ״�����230��C?270��C��Ϊ������Ϊ�о��ϳ�������ʵ���ʼ��ɱ�n(H2)��n(C0),�ֱ���230��C��2500C��2700C����ʵ�飬�����ͼ��
CH3OH (g), ��H<0�ϳɼ״�����230��C?270��C��Ϊ������Ϊ�о��ϳ�������ʵ���ʼ��ɱ�n(H2)��n(C0),�ֱ���230��C��2500C��2700C����ʵ�飬�����ͼ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��25% | B��40% | C��35% | D��80% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ȫ�� | B���٢ڢ� | C���٢ۢ� | D���٢ۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
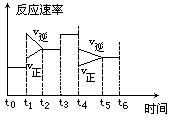
| A��t 0~t1�� | B��t2~t3 | C��t3~t4 | D��t5~t6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 cC��g������H��0���ڵ��������½��С��ı�������Ӧ��������I��II��III����ϵ�и�����Ũ����ʱ��仯����������ͼ��ʾ��
cC��g������H��0���ڵ��������½��С��ı�������Ӧ��������I��II��III����ϵ�и�����Ũ����ʱ��仯����������ͼ��ʾ��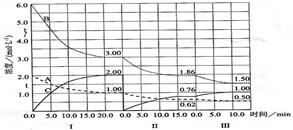
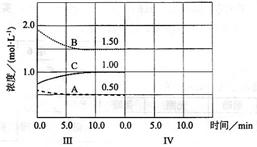
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2NH3(g) ��H����92.20 kJ��mol��1��
2NH3(g) ��H����92.20 kJ��mol��1��| ʱ�䣨h�� ���ʵ�����mol�� | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | N2 | 1.00 | 1.00 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com