
| A.由无水醋酸钠制CH4 | B.由乙醇制C2H4 |
| C.由电石制C2H2 | D.由氯酸钾制O2 |
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源:不详 题型:单选题
| A.石油催化裂化 |
| B.电解无水氯化镁制镁 |
| C.过氧化钠投入水中制氧气 |
| D.铝与氧化铁发生铝热反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CaO与H2O反应是吸热反应 |
| B.H2SO4与NaOH反应是放热反应 |
| C.H2燃烧是放热反应 |
| D.CaCO3受热分解是吸热反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 时:
时:
A.氢氟酸的电离方程式及热效应可表示为: |
B.当V="20" mL时,溶液中: |
C.当V="20" mL时,溶液中: |
D.当v>0时,溶液中一定存在 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.ΔH1>ΔH3>ΔH2 | B.ΔH1<ΔH2<ΔH3 |
| C.ΔH1=ΔH2=ΔH3 | D.ΔH1<ΔH3<ΔH2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

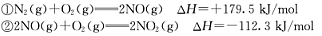


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com