
【题目】下列物质的性质比较,正确的是( )
A.非金属性:P>S>Cl
B.碱性:NaOH>KOH>RbOH
C.气态氢化物稳定性:HF>HCl>HBr
D.酸性:H2SO4>HClO4>HBrO4
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关,下列有关说法正确的是 ( )
A. 医院里的血液透析利用了胶体的性质
B. PM2.5中含有铅、铬、钒、砷等对人体有害的金属元素
C. 工业冶炼铝常用焦炭还原氧化铝
D. 煤经过气化和液化的物理变化可变为清洁燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将10.7g 氯化铵固体与足量熟石灰混合加热,使之充分反应。
(1)写出反应的化学方程式:____________________。
(2)生成的氨气在标准状况下的体积是______________L。
(3)用氨可以把一氧化氮还原成氮气,反应的化学方程式为:__________,此反应中氧化产物与还原产物的物质的量之比为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列每组物质发生状态变化时所克服的微粒间的相互作用属于同种类型的是( )
A.食盐和蔗糖熔化
B.金刚石和硫熔化
C.碘和干冰升华
D.二氧化硅和氧化钠熔化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO4·7H2O)可作还原剂、着色剂、制药等,在不同温度下易分解得各种铁的氧化物和硫的氧化物。已知SO3是一种无色晶体,熔点16.8℃,沸点44.8℃,氧化性及脱水性较浓硫酸强,能漂白某些有机染料,如品红等。回答下列问题:
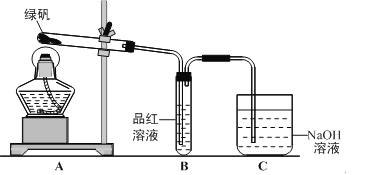
(1)甲组同学按照上图所示的装置,通过实验检验绿矾的分解产物。装置B中可观察到的现象是___________,甲组由此得出绿矾的分解产物中含有SO2。装置C的作用是__________________。
(2)乙组同学认为甲组同学的实验结论不严谨,认为需要补做实验。乙对甲组同学做完实验的B装置的试管加热,发现褪色的品红溶液未恢复红色,则可证明绿矾分解的产物中_____________。(填字母)
A.不含SO2 B.可能含SO2 C.一定含有SO3
(3)丙组同学查阅资料发现绿矾受热分解还可能有O2放出,为此,丙组同学选用甲组同学的部分装置和下图部分装置设计出了一套检验绿矾分解气态产物的装置:
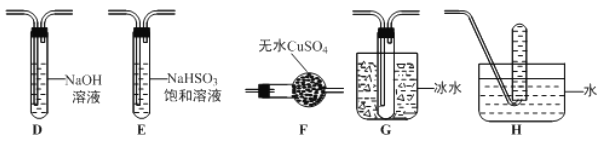
①丙组同学的实验装置中,依次连接的合理顺序为 _______________。
②能证明绿矾分解产物中有O2的实验操作及现象是_______________。
(4)为证明绿矾分解产物中含有三价铁,选用的实验仪器有试管、胶头滴管、_______________ ;选用的试剂为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 臭氧具有强氧化性,可用于饮用水消毒
B. 二氧化硅在高温下用焦炭还原可制得粗硅
C. 电解饱和氯化钠溶液可以得到金属钠
D. 镁合金密度较小,可用于制造火箭、导弹和飞机的部件等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一定条件,可逆反应:mA+nB![]() pC达到平衡状态。
pC达到平衡状态。
①若A、C是气体,而且m+n=p,减小压强可使平衡发生移动,则平衡向____________(填“正”或“逆”)反应方向移动。
②若A、B、C均为气体,且m+n<p,加热后,可使混合气体平均摩尔质量增加,则正反应是____________(填“吸热”或“放热”)反应。
③若在反应过程中,C的物质的量n(C)随时间的变化关系如图所示(从t1时间开始对反应体系升高温度)。则a、b两点的正反应速率:v(a)____________v(b)(填“>”、“<”或“=”);

(2)Na2CO3溶液呈碱性,其原因是(用离子方程式表示)___________________;由同浓度的Na2CO3和NaHCO3组成的混合溶液中离子浓度由大到小的顺序为____________________;
(3)某温度下,纯水的c(H+)=3×10-7mol/L,Na2S和NaOH两溶液的pH均为12,则两溶液中由水电离出的c(H+)的比值为_________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用![]() X表示原子:
X表示原子:
(1)中性原子的中子数:N=________。
(2)阳离子的中子数:AXn+共有x个电子,则N=________。
(3)阴离子的中子数:AXn-共有x个电子,则N=________。
(4)中性分子中子数:12C18O2分子中,N=________。
(5)A2-原子核内有x个中子,其质量数为m,则n gA2-所含电子的物质的量为________mol。
(6)某元素的同位素![]() X,其氯化物XCl2。1.11 g溶于水制成溶液后,加入1 mol/L的AgNO3溶液20 mL恰好完全反应。若这种同位素原子核内有20个中子,则:
X,其氯化物XCl2。1.11 g溶于水制成溶液后,加入1 mol/L的AgNO3溶液20 mL恰好完全反应。若这种同位素原子核内有20个中子,则:
①Z值和A值:Z=________,A=________;
②X元素在周期表中的位置_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 植物油通过取代反应可转化为人造脂肪
B. 葡萄糖是生产补钙剂葡萄糖酸钙的原料
C. 苯是煤干馏或石油分馏的主要产品之一
D. 乙醇、乙酸均可与钠、氢氧化钠发生反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com