
| C(标)V(标) |
| V(待) |
| C(标)V(标) |
| V(待) |
| C(标)V(标) |
| V(待) |
| C(标)V(标) |
| V(待) |
| C(标)V(标) |
| V(待) |


 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
A、用石墨电极电解MgCl2饱和溶液的总反应为:Mg2++2Cl-
| ||||
| B、精炼铜过程中阴极增重6.4g时,电路中转移电子数大于0.2NA | ||||
| C、氢氧酸性燃料电池放电时,正极反应为:O2+4e-+4H+=2H2O | ||||
| D、铅蓄电池在放电过程中,负极质量增加,正极质量增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
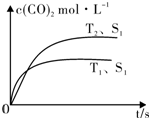
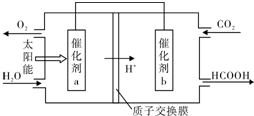
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
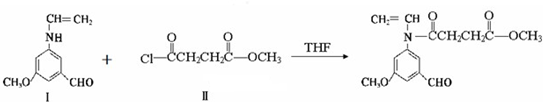
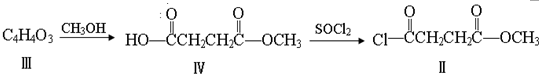
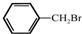 与
与 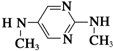 在一定条件下按物质的量2:1的比例发生类似
在一定条件下按物质的量2:1的比例发生类似查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
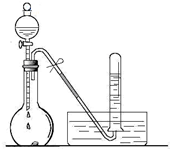 某校化学实验小组同学进行有关NO2气体的系列实验.
某校化学实验小组同学进行有关NO2气体的系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:
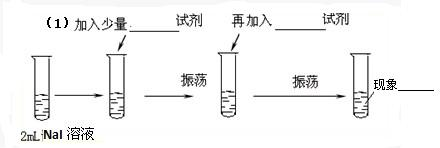
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com